Kapitel IV Wärmelehre und Thermodynamik. g) Hauptsätze und Kreisprozesse U T
|
|
|
- Nicole Schräder
- vor 7 Jahren
- Abrufe
Transkript
1 apitel IV Wärmelehre und hermodynamik a) Definitionen b) emperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g) auptsätze und reisprozesse h) Dampfdruck, Diffusion, Osmose i) Wärmeübertragung Strahlung, Leitung, onvektion g) auptsätze und reisprozesse. auptsatz Energiesatz Wärme ist Form von Energie Erfahrung: Arbeit vollst. Wärme geht. auptsatz Entropiesatz Erfahrung: Wärme vollst. Arbeit geht nicht Erfahrung: kalt warm nicht von selbst 3. auptsatz absoluter Nullpunkt ist unerreichbar (genau: später) Definitionen: Quasistatisch: System immer im D Gleichgewicht, d.h. Z.Ä. sehr langsam Reversibel: umkehrbar, System kehrt zu Ausgangszustand zurück Reservoir: großes System, emperatur bleibt konstant, auch wenn Wärme zu/abgeführt wird (z. B. Umgebung, Universum, Wärmespeicher) i). auptsatz und Zustandsänderungen. auptsatz du δq + δw Q Wärme U Innere Energie W Arbeit Achtung Vorzeichen: Alles, was ins System geht, positiv Alles was hinausgeht, negativ (vom Syst. geleistete Arbeit: negativ, am System geleistete Arbeit: positiv) hermodynamik mechanische Wirkung von Wärme heorie der Dampfmaschinen Praktisch wichtige Fragen: ) was passiert mit der Wärme, die ein System aufnimmt? ) Wieviel Arbeit kann aus best. Menge von Wärme gewonnen werden? (d.h. wie groß ist der Wirkungsgrad?) Frage : was passiert mit der Wärme, die einemsystem bei Zustandsänderung zugeführt wird? Zustandsänderungen Neuauflage Isochor V const, dv 0 du δq δq c v,mol n d du c v,mol n d n U c v,mol V const Spezifische Wärme bei V const System erwärmt sich
2 Isobar p const, dp 0 δq c p,mol n d; δq du +pdv mit dp 0 erweitern du + pdv + Vdp Neue Größe: U + pv, Enthalpie (Praxis im Labor: oft Normaldruck p const) d δq c p,mol n d n c p,mol p const Spezifische Wärme bei p const. System erwärmt sich und dehnt sich aus Isotherm const, d 0 δq du +pdv du 0 δq pdv U f/ nr du f/ nr d 0 gesamte zugeführte Wärme geht in Ausdehnungsarbeit Und wenn keine Wärme zugeführt wird? d.h. δq 0, adiabatisch. O V p pv κ κ κ κ const const const Poissongleichungen Adiabatengleichungen Frage : Wieviel Arbeit kann aus best. Menge von Wärme gewonnen werden? Indikatordiagramm W Weg Weg 3 Weg W entspricht Fläche unter Weg-kurve C p dv Arbeit abhängig vom Weg Arbeit keine Zustandsgröße ii) Carnot scher reisprozess Idealisierte Dampfmaschine Wärme wird zugeführt, System leistet Arbeit Quasistatisch nur Gleichgewichtszustände Reversibel System kehrt in Ausgangszustand zurück einerlei Reibungsverluste (Zylinder/olben/Umgebungsluft) Reversibler Prozess: System geht in Ausgangszustand zurück dummer Prozess : Expansion: W gewonnen ompression: W wieder weg
3 Brauche Fläche > 0 im Indikatordiagramm Weg bei Expansion anderer als bei ompression viel Arbeit pro Zyklus: große Fläche Quelle: Wikipedia isotherme Exp. 3 adiabatische Exp. 3 4 isotherme ompr. 4 adiabatische ompr. Wichtig: Wirkungsgrad η einer Maschine entnehme Wärme aus heißem Reservoir Maschine leistet Arbeit ΔW und gibt Wärme an kaltes Reservoir ab (hier: immer Betrag) ΔW η η η < emp. heiß emp. kalt η groß für klein Τ Η groß Wichtig: η < Clausius scher Satz: Es gibt keine zwischen einem warmen und einem kalten Reservoir arbeitende Maschine, deren Wirkungsgrad größer ist als der Wirkungsgrad des Carnotprozesses Realistische Zeichnung: O Ganz winzige Fläche Ganz wenig Arbeit pro Zyklus Wird für reale Maschinen nie verwendet (Reibungsverluste.) at maximal möglichen Wirkungsgrad maximum efficiency ist sehr ineffektive Maschine iii) Andere reisprozesse Besser: Druck in Grenzen halten Fläche im Indikatordiagramm größer Früher: Energieträger v.a. ohle eute: andere Energieträger (Sonnenenergie, ernenergie, Gas, erosin, Benzin, Diesel, Biogas..) 3
4 Stirling Prozess Ottomotor. O R V V R. ompressionsverhältnis κ. Adiabatenkoeff. η R κ R max ca. 0 Quelle: Wikipedia Dieselmotor Zur Info: nicht Prüfungsstoff V R ; V R V V 3 η κ R κ R R κ R ca R mögl. groß effizienter als Otto-Motor Quelle: Wikipedia Braytonprozess (Gasturbine, Strahltriebwerk) ältemaschine (ühlschrank) Maschine verkehrt herum laufen lassen Investiere Arbeit, pumpe Wärme von kalt nach warm warm Umgebung, U, kalt Innenraum Nutzen (von kalt nach warm ) Quelle: Wikipedia Leistungsziffer: Q L ΔW Q Q > 4
5 Wärmepumpe pumpt Wärme von Umgebung ( ) nach Innenraum ( ) Nutzen: Leistungsziffer Q L ΔW Q Q > Quelle: Wikipedia ypisch: L ungef. 5-6 iv). auptsatz Wärme muss an kaltes Reservoir abgegeben werden η < Wärme Arbeit geht nicht vollständig Formulierungen für. S Quelle Wikipedia elvin es gibt keinen Prozess, dessen einzige Wirkung darin besteht, dass Wärme aus einem Reservoir vollständig in Arbeit umgesetzt wird ( es gibt kein perpetuum mobile zweiter Art) Clausius es gibt keinen Prozess, dessen einzige Wirkung darin besteht, dass Wärme von einem kalten Reservoir zu einem warmen fließt v) Entropie und 3. auptsatz Carnot: Entropie η δq ds reduzierte Wärme 5
6 ) Carnot: reversibel, Ausgangszustand Endzustand ds 0, S ist Zustandsgröße ) 0? ds, ältemaschine: ΔW 3. auptsatz (Nernst) es gibt keinen endlichen reisprozess, durch den der absolute Nullpunkt erreicht werden könnte der absolute Nullpunkt ist unerreichbar Nullpunkt von Entropie: S 0 für 0 Allgemein: bei Prozess ds 0 reversibel: ds 0 irreversibel: ds > 0 Gleiche δq gibt unterschiedliche ds abhängig von vi) Entropie mikroskopisch O Mikrozustand: welches Molekül ist wo (links/rechts) Makrozustand: wie viele Moleküle sind wo (links/rechts) Postulat der gleichen a-priori Wahrscheinlichkeit N Moleküle, Möglichkeiten (links / rechts) Zustand : alle links P -N Zustand : gleich viele links wie rechts N 00 P 0-30 Zust. um N mal wahrscheinlicher als Def: S k ln P ΔS k N ln (Unterschied zwischen Zust. und ) Boltzmann: S k ln W W: Zahl der Mikrozustände, die einen bestimmten Makrozustand darstellen W sehrgroße Zahl Zusammenhang mikro / makro Def. von S.O 6
7 Entropie ist Maß für Unordnung im System. S: Entropiesatz System geht von selbst nur in einen Zustand über, der weniger geordnet ist als der Ausgangszustand System geht von selbst nur in einen wahrscheinlicheren Zustand über vii) Freie Energie / freie Enthalpie wieso können geordnete Strukturen entstehen? System mit Umgebung Prozess spontan, wenn ds umgeb ds system Wärme wird an Umgebung abgegeben Entropie: δq ds δq ds δq min ds an Umgebung Definition F: F U S Freie Energie (elmholtz) für const df du ds ( - S d) Wenn auch p const. Definition G: G S Freie Enthalpie, Gibbs dg d ds ( - S d) const freie Enthalpie Anteil der Enthalpie, der bei reversiblem isobarem Prozesses in jede beliebige Energieform umwandelbar ist. ds. Entropiesteuer an Universum Wichtig für chemische Reaktionen Gleichgewicht dort, wo G Min spontane Reaktion in Richtung, in der dg < 0 h) Dampfdruck, Diffusion, Osmose Alle hängen mit Entropie zusammen Bei allen ransport von Molekülen / Materie System geht von selbst nur in einen Zustand höherer Entropie über i) Dampfdruck über reiner Flüssigkeit Flüssigkeit im Gleichgewicht mit ihrem Dampf Gleichgewichtsdampfdruck Falls Mischung Dampf / Luft: Dampfdruck entspr. Partialdruck Dampfdruck: Gleichgewicht über G Diffusion: irreversible Durchmischung Osmose: Gleichgewicht 7
8 Über jeder Flüssigkeitsoberfläche in einem geschlossenen Gefäß stellt sich bestimmter Dampfdruck ein Gleichgewichtsdampfdruck p s Wasser: Clausius-Clapeyrongleichung (für kleine Δ). O p ln p R v,mol v,mol Verdampfungsenthalpie kj/mol R Gaskonstante,, emperatur p, p Sätt.DD bei, Definition: absolute Feuchte ρ w : Wasserdampfgehalt in g/m³ Sättigungsmenge ρ s : maximal möglicher W.D. Gehalt (bei ) Relative Feuchte f: [f] % ρ f w *00 ρs p f w *00 ps ii) Lösungen / Mischungen Lösung: Mischung auf molekularer Basis evtl. mit Dissoziation gelöste Ionen Stoff A im Überschuss, Stoff B sehr wenig Stoff A Lösungsmittel Stoff B gelöster Stoff onzentration (g/l, mol/l,...) gesättigte Lösung max. mögliche onz. Lösung von Gas in Flüssigkeit enry sches Gesetz c p part c onzentration enrykonstante p part Partialdruck Gas Ideale Lösung Raoult sches Gesetz p p Dampfdruck A,Lös. n x A A p x A Molenbruch A,rein na + nb n A, n B Molzahlen A... Lösungsmittel, B... gelöster Stoff Definition von f wie Raoult sches Gesetz konstante (definierte) Feuchte über Salzlösungen (LiCl: %, NaCl 76%, SO 4 97%) Luftbefeuchtung: abhängig von absoluter Feuchte (Winter: trockene eizungsluft ) limaanlage: feuchte Außenluft gekühlt Entfeuchtung nötig Föhn in Alpen 8
9 Lösungswärme (Lösungsenthalpie ) exotherm: Wärme wird frei, < 0 z. B. LiCl in O, fast alle Gase in O Löslichkeit bei endotherm: Wärme wird verbraucht, > 0 z. B. (N 4 ) SO 4 in O Löslichkeit bei Dampfdruck über Lösung kleiner (siehe Raoult) Siedepunktserhöhung Δ och A*b A ebullioskopische onst. b Molalität (mol/kg) z. B. Salzwasser Gefrierpunktserniedrigung Δ Fest B*b B kryoskopische onst. z. B. Salzwasser (gesättigte Lösung: Δ Fest - 8 C Elektrolytlösungen: nicht ideal Dissoziation in Ionen i (van t off Faktor); i Zahl der Ionen p p A,Lös. A,rein n A n + in A Wichtige Lösungen Meerwasser ca. 35 g /kg O physiologische ochsalzlösung 9.5 g /kg O Sodawasser, O in Wasser, Schlagobers, Milch, Eiweiß, Proteine,... B iii) Diffusion treibende raft : zweiter auptsatz muss da sein: onzentrationsgradient. Fick sches Gesetz (konst. Gradient): r dc J D dx r J Dgrad c J Fluss / (Zeit * Fläche) D Diffusionskoeffizient c onzentration dx kleine Wegstrecke Moleküle immer in Bewegung ohe onz. Niedrige onz. Nettofluss von hoch zu niedrig Gasaustausch in Lungenbläschen CO gegen O Quelle: Wikipedia 9
10 . Fick sches Gesetz (Diffusionsgleichung) z. B. Freisetzung von best. Menge Stoff zu best. Zeit t, wie ändert sich onz.? c r divj D div grad c Δc t Δ Laplace Operator Gasmolekül x(t ) x(t ) Staubpartikel x(t 3 ) schulen.eduhi.at/.../brownsche_bewegung.htm Brown scher Bewegung. O Mittl. Verschiebungsquadrat x² x Dt D k B k D 3πηd Einstein, Smoluchowski η Zähigkeit d Partikeldurchmesser B Beweglichkeit (Geschw. pro raft) D Diffusionskoeff. [D] m²/sek iv) Osmose Diffusion: onzentrationsunterschied Osmose: onzentrationsunterschied + semipermeable Membran, lässt nur kleine Moleküle durch Osmotischer Druck p osm : p osm c n k c n N/V, i van t off faktor p osm i c n k k Boltzmannkonst. p osm i c m R emperatur, R Gaskonst. c m n/v molare onz. z. B. Zuckerlösung / Wasser Wasser Zuckerlösung Lösung hohe onz / Lösung niedr. onz Wasser von niedrig zu hoch, bis isoton Umkehrosmose für Reinstwasser Dialyse Blutkörperchen, reines Wasser platzt Blutkörperchen, konz. Salzlösung schrumpft 0
11 i) Wärmeübertragung Strahlung, Leitung, onvektion Bisher: Wärme wird aufgenommen / abgegeben Wärme Energie, die bei Vorliegen eines emperaturgradienten übertragen wird Jetzt: wie wird Wärme übertragen mit / ohne Materietransport i) Absorption und Emission von Licht Licht wird nur in Quanten abgegeben (emittiert) oder aufgenommen (absorbiert) leifi.physik.uni-muenchen.de E h f h 6, Js Planck sches Wirkungsquantum Intensität: Zahl der Quanten Energie: proportional zur Frequenz c λ f; f konstant, λ abhängig vom Medium (später Optik) ermschema der Atome: Elektronen erlaubte Energieniveaus Zwischenzustände verboten falls Quant genau ΔE zwischen zwei Zuständen Absorption, e - wird angeregt, geht in höheren Energiezustand über sonst: keine Absorption, Licht geht durch Absorptionsspektrum: dunkle Linien im färbigen Spektrum z. B. Fraunhofer sche Linien Emissionsspektrum: wenn e - aus angeregtem in Grundzustand übergeht: Emission von Quant mit genau dieser ΔE, d. h. Frequenz helle Linien auf dunklem Grund z. B. Na D Linie, λ 589 nm
12 leifi.physik.uni-muenchen.de Fraunhofer sche Linien pen.physik.uni-kl.de Spektren von gasförmigen Atomen: scharfe Linien Spektren von Molekülen: v. a. im IR Schwingungsbanden, nicht scharf; z. B. O, CO, C 4 Festkörper: in breiten Frequenzbereichen prakt. alle Energiezustände anregbar kontinuierliche Emission/ Absorption Schwarzer Strahler Definition: Relatives spektrales Absorptionsvermögen α λ absorbierte / einfallende Strahlungsenergie bei λ Relatives spektrales Reflexionsvermögen ρ λ reflektierte / einfallende Str.En. bei λ Energieerhaltung: α λ + ρ λ irchhoff sches Gesetz: α λ ε λ ε λ rel. spektr. Emissionsvermögen ii) Schwarzer Strahler / örper absorbiert EM Strahlung jeder Frequenz α λ für alle λ reflektiert nichts ρ λ 0 für alle λ emittiert EM Strahlung aller Frequenzen ε λ für alle λ Spektralverteilung gegeben durch Planck sches Strahlungsgesetz I(f,)df 8πhf 3 c 3 df hf exp k Strahlungsgesetz von Planck hf << k : 8πf I(f,)df 3 c hf >> k : 8πhf I(f,)df 3 c k df 3 hf exp df k Rayleigh-Jeans Wien I(f,) spektrale Strahlungsflussdichte bei in Frequenzintervall f + df Quelle: Wikipedia
13 Aus Planck schem Gesetz: Maximum der Verteilung Wien sches Verschiebungsgesetz λ max const m λ max Wellenl. wo max. Emission Gesamtstrahlungsflussdichte (Integral) Stefan-Boltzmann sches Gesetz E σ 4 σ W/(m². 4 ) Stefan-Boltzmann-onstante Wenn örper nicht schwarz : E α.σ. 4 oder E ε.σ. 4 (eigentlich hier: bei allen Wellenlängen) Real: immer Spektralbereiche, wo besser / schlechter absorbiert wird herm. IR: fast alles schwarz Sichtbares Spektrum: Farben durch selektive Absorption in einigen Spektr.Bereichen Strahlungsgleichgewicht const, wenn Summe einfallend Summe abgestrahlt z. B. Strahlungstemperatur der Erde achelofen Verspiegelungen Solarduschen / Solarkocher kein Materietransport, EM Wellen iii) Wärmeleitung Diffusion: ransport von eilchen bei onzentrationsgradient Wärmeleitung: Weitergabe von Schwingungszuständen bei emperaturgradient Wärmetransport kein Materietransport 3
14 r J λ.grad dq r r P J.dA dt Stationär, Platte: A P λ Δ d Stationär, Zylinder πλl P Δ ra ln r i J Wärmestromdichte W/m² λ Wärmeleitfähigkeit W/(m.) P Leistung W Q Wärme/Zeit A Fläche d Dicke von Platte l Länge von Zylinder r i, r a Innen / Außenradius λ W/(m.) Wasser (ruhend) 0.57 Gestein Feuchter Boden 0.5 (orf). (Sand) Org. Mat (Wolle) 0.08 (olz) 0.6 (Fett). 0. (aut) Schnee Eis.4 Luft 0.05 (ruhig) 5 (turb) Stahl 50 Cu 400 Gase: λ / η.c v η Zähigkeit c v spez. Wärme (Vconst.) (beide: unabh. von p) Änderung von mit Zeit a. Δ dt a λ ρ c p a emperaturleitfähigkeit, Fourier-oeff. λ Wärmeleitfähigkeit c p spez. Wärme ρ Dichte Δ Lapl. Operator iv) onvektion Freie onvektion: durch Dichteunterschied ( warme Luft steigt auf) Erzwungene onvektion: Strömung durch äußere Ursache (Ventilator, Pumpe, etc.) Wärmetransport und Materietransport upload.wikimedia.org 4
15 Nusseltzahl Nu d/δ d tats. Schichtdicke δ Äquivalentdicke δ statt d in Wärmeleitungsgleichung einsetzen, Wärme/Zeit normal ausrechnen z. B.. O, Grashofzahl, Nusseltzahl bei freier / erzw. onvektion (Formeln nicht Prüfungsstoff) Vergleich Diffusion / Wärmeleitung r dc J D D.grad c dx c r divj D div grad c Δc t r J λ.grad a. Δ dt a Genau die gleichen Differentialgleichungen Mit Nusseltzahl: auch für onvektion λ ρ c p Ziel erreicht? Verständnis der Grundlagen emperaturmessung Phasenübergänge und ihre Bedeutung Mikroskopische / makroskopische Betrachtung Grundlage von reisprozessen ransport von Wärme und / oder Materie 5
h) Dampfdruck, Diffusion, Osmose
 h) Dampfdruck, Diffusion, Osmose Alle hängen mit Entropie zusammen Bei allen Transport von Molekülen / Materie System geht von selbst nur in einen Zustand höherer Entropie über Dampfdruck: Gleichgewicht
h) Dampfdruck, Diffusion, Osmose Alle hängen mit Entropie zusammen Bei allen Transport von Molekülen / Materie System geht von selbst nur in einen Zustand höherer Entropie über Dampfdruck: Gleichgewicht
Kapitel IV Wärmelehre und Thermodynamik
 Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas - makroskopisch e) Das reale Gas / Phasenübergänge f) Das ideale Gas mikroskopisch g)
Kapitel IV Wärmelehre und Thermodynamik ctd.
 Kapitel IV Wärmelehre und Thermodynamik ctd. a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas mikroskopisch e) Das idealegas - makroskopisch f) Das reale Gas / Phasenübergänge
Kapitel IV Wärmelehre und Thermodynamik ctd. a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas mikroskopisch e) Das idealegas - makroskopisch f) Das reale Gas / Phasenübergänge
Kapitel IV Wärmelehre und Thermodynamik ctd.
 Kapitel IV Wärmelehre und Thermodynamik ctd. a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas mikroskopisch e) Das idealegas - makroskopisch f) Das reale Gas / Phasenübergänge
Kapitel IV Wärmelehre und Thermodynamik ctd. a) Definitionen b) Temperatur c) Wärme und Wärmekapazität d) Das ideale Gas mikroskopisch e) Das idealegas - makroskopisch f) Das reale Gas / Phasenübergänge
Der 1. Hauptsatz. Energieerhaltung:
 Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Die Carnot-Maschine SCHRITT III. Isotherme Kompression bei einer Temperatur T 2 T 2. Wärmesenke T 2 = konstant. Nicolas Thomas
 Die Carnot-Maschine SCHRITT III Isotherme Kompression bei einer Temperatur T 2 T 2 Wärmesenke T 2 = konstant Die Carnot-Maschine SCHRITT IV Man isoliert das Gas wieder thermisch und drückt den Kolben noch
Die Carnot-Maschine SCHRITT III Isotherme Kompression bei einer Temperatur T 2 T 2 Wärmesenke T 2 = konstant Die Carnot-Maschine SCHRITT IV Man isoliert das Gas wieder thermisch und drückt den Kolben noch
II. Wärmelehre. II.2. Die Hauptsätze der Wärmelehre. Physik für Mediziner 1
 II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
Zusammenfassung: Zustandsänderungen (jeweils für 1 mol)
 Zusammenfassung: Zustandsänderungen (jeweils für mol) dq du p d isochor ( = const) isochor : dq du d 0 C d keine mechanische rbeit isobar (p = const) isotherm ( = const) adiabatisch (Q = const) isobar
Zusammenfassung: Zustandsänderungen (jeweils für mol) dq du p d isochor ( = const) isochor : dq du d 0 C d keine mechanische rbeit isobar (p = const) isotherm ( = const) adiabatisch (Q = const) isobar
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #16 am 0.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
(b) Schritt I: freie adiabatische Expansion, also ist δw = 0, δq = 0 und damit T 2 = T 1. Folglich ist nach 1. Hauptsatz auch U = 0.
 3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Thermodynamik I PVK - Tag 2. Nicolas Lanzetti
 Thermodynamik I PVK - Tag 2 Nicolas Lanzetti Nicolas Lanzetti 05.01.2016 1 Heutige Themen Carnot; Wirkungsgrad/Leistungsziffer; Entropie; Erzeugte Entropie; Isentroper Wirkungsgrad; Isentrope Prozesse
Thermodynamik I PVK - Tag 2 Nicolas Lanzetti Nicolas Lanzetti 05.01.2016 1 Heutige Themen Carnot; Wirkungsgrad/Leistungsziffer; Entropie; Erzeugte Entropie; Isentroper Wirkungsgrad; Isentrope Prozesse
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Hauptsatz der Thermodynamik
 0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
Thermodynamik (Wärmelehre) IV Kreisprozesse und Entropie
 Physik A VL7 (..0) hermodynamik (Wärmelehre) IV Kreisprozesse und Entropie Kreisprozesse Carnot scher Kreisprozess Reale Wärmemaschinen (tirling-motor, Dampfmaschine, Otto- und Dieselmotor) Entropie Der.
Physik A VL7 (..0) hermodynamik (Wärmelehre) IV Kreisprozesse und Entropie Kreisprozesse Carnot scher Kreisprozess Reale Wärmemaschinen (tirling-motor, Dampfmaschine, Otto- und Dieselmotor) Entropie Der.
Thermodynamik Hauptsatz
 Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
Wärmelehre Wärme als Energie-Form
 Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Vorlesung Physik für Pharmazeuten PPh - 08
 Vorlesung Physik für Pharmazeuten PPh - 08 Wärmelehre 18.12. 2006 Der erste Hauptsatz der Thermodynamik Verallgemeinerung der Energieerhaltung von makroskopischen Systemen auf mikroskopische Der erste
Vorlesung Physik für Pharmazeuten PPh - 08 Wärmelehre 18.12. 2006 Der erste Hauptsatz der Thermodynamik Verallgemeinerung der Energieerhaltung von makroskopischen Systemen auf mikroskopische Der erste
Q i + j. dτ = i. - keine pot. und kin. Energien: depot. - adiabate ZÄ: Q i = 0 - keine technische Arbeit: Ẇ t,j = 0
 Institut für hermodynamik hermodynamik - Formelsammlung. Hauptsätze der hermodynamik (a. Hauptsatz der hermodynamik i. Offenes System de = de pot + de kin + du = i Q i + j Ẇ t,j + ein ṁ ein h tot,ein aus
Institut für hermodynamik hermodynamik - Formelsammlung. Hauptsätze der hermodynamik (a. Hauptsatz der hermodynamik i. Offenes System de = de pot + de kin + du = i Q i + j Ẇ t,j + ein ṁ ein h tot,ein aus
13.Wärmekapazität. EP Vorlesung 14. II) Wärmelehre
 13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
22. Entropie; Zweiter Hauptsatz der Wärmelehre
 22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
Zur Erinnerung. Spezifische Wärmekapazität. Spezifische Molwärme idealer Gase: C p und C V
 Zur Erinnerung Stichworte aus der 18. orlesung: Spezifische Wärmekapazität Spezifische Molwärme idealer Gase: C p und C C ½ f R C P C + R Spezifische Molwärme von Festkörpern (Dulong-Petit sches Gesetz)
Zur Erinnerung Stichworte aus der 18. orlesung: Spezifische Wärmekapazität Spezifische Molwärme idealer Gase: C p und C C ½ f R C P C + R Spezifische Molwärme von Festkörpern (Dulong-Petit sches Gesetz)
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen!
 1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
Zur Erinnerung. Wärmetransport durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung. Planck sches Strahlungsgesetz. Stefan-Boltzman-Gesetz
 Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Statistische Zustandsgröße Entropie Energieentwertung bei Wärmeübertragungen II. Hauptsatz der Thermodynamik
 Statistische Zustandsgröße Entropie Energieentwertung bei Wärmeübertragungen II. Hauptsatz der hermodynamik Die nachfolgenden Ausführungen stellen den Versuch dar, die zugegeben etwas schwierige Problematik
Statistische Zustandsgröße Entropie Energieentwertung bei Wärmeübertragungen II. Hauptsatz der hermodynamik Die nachfolgenden Ausführungen stellen den Versuch dar, die zugegeben etwas schwierige Problematik
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Klausur Thermodynamik E2/E2p SoSe 2019 Braun. Formelsammlung Thermodynamik
 Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Winter-Semester 2017/18. Moderne Theoretische Physik IIIa. Statistische Physik
 Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Winter-Semester 2017/18 Moderne Theoretische Physik IIIa Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Do 11:30-13:00, Lehmann Raum 022, Geb 30.22 http://www.tkm.kit.edu/lehre/
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
3 Diskussion und Beispiele
 Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
Ferienkurs Experimentalphysik 2
 Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
4.6 Hauptsätze der Thermodynamik
 Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
10. Thermodynamik Der erste Hauptsatz Der zweite Hauptsatz Thermodynamischer Wirkungsgrad Der Carnotsche Kreisprozess
 Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
4.1.1 Kelvin-Planck-Formulierung des 2. Hauptsatzes der Thermodynamik. Thermischer Wirkungsgrad einer Arbeitsmaschine:
 4. Zweiter Hauptsatz der Thermodynamik 4.1. Klassische Formulierungen 4.1.1 Kelvin-Planck-Formulierung des 2. Hauptsatzes der Thermodynamik Thermischer Wirkungsgrad einer Arbeitsmaschine: Beispiel Ottomotor
4. Zweiter Hauptsatz der Thermodynamik 4.1. Klassische Formulierungen 4.1.1 Kelvin-Planck-Formulierung des 2. Hauptsatzes der Thermodynamik Thermischer Wirkungsgrad einer Arbeitsmaschine: Beispiel Ottomotor
Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie.
 Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie. Die Hauptsätze der Thermodynamik Kurze Zusammenfassung der Hauptsätze 0. Hauptsatz: Stehen zwei
Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie. Die Hauptsätze der Thermodynamik Kurze Zusammenfassung der Hauptsätze 0. Hauptsatz: Stehen zwei
Beispiel für ein thermodynamisches System: ideales Gas (Edelgas)
 10. Hauptsätze tze der Wärmelehre Thermodynamik: zunächst: Klassische Mechanik punktförmiger Teilchen, starrer und deformierbarer Körper aber: Bewegungsgleichungen für N=10 23 Teilchen mit 6N ariablen
10. Hauptsätze tze der Wärmelehre Thermodynamik: zunächst: Klassische Mechanik punktförmiger Teilchen, starrer und deformierbarer Körper aber: Bewegungsgleichungen für N=10 23 Teilchen mit 6N ariablen
Thermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden.
 Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
1 Thermodynamik allgemein
 Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundlagen der Quantentheorie
 Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
3.6 Kreisprozesse. System durchläuft eine Folge von Zustandsänderungen im pv-diagramm, so dass Anfangszustand = Endzustand. Bsp: 4-Takt Ottomotor
 System durchläuft eine Folge von Zustandsänderungen im p-diagramm, so dass Anfangszustand Endzustand. Bsp: 4-at Ottomotor Die eingesetzten nutzbaren Energien/Arbeiten ergeben sich ieder aus den jeeiligen
System durchläuft eine Folge von Zustandsänderungen im p-diagramm, so dass Anfangszustand Endzustand. Bsp: 4-at Ottomotor Die eingesetzten nutzbaren Energien/Arbeiten ergeben sich ieder aus den jeeiligen
f) Ideales Gas - mikroskopisch
 f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Physik für Maschinenbau. Prof. Dr. Stefan Schael RWTH Aachen
 Physik für Maschinenbau Prof. Dr. Stefan Schael RWTH Aachen Vorlesung 11 Brechung b α a 1 d 1 x α b x β d 2 a 2 β Totalreflexion Glasfaserkabel sin 1 n 2 sin 2 n 1 c arcsin n 2 n 1 1.0 arcsin
Physik für Maschinenbau Prof. Dr. Stefan Schael RWTH Aachen Vorlesung 11 Brechung b α a 1 d 1 x α b x β d 2 a 2 β Totalreflexion Glasfaserkabel sin 1 n 2 sin 2 n 1 c arcsin n 2 n 1 1.0 arcsin
Ferienkurs Experimentalphysik II Thermodynamik Grundlagen
 Ferienkurs Experimentalphysik II Thermodynamik Grundlagen Lennart Schmidt 08.09.2011 Inhaltsverzeichnis 1 Grundlagen 3 1.1 Temperatur und Wärme............................ 3 1.2 0. und 1. Hauptsatz..............................
Ferienkurs Experimentalphysik II Thermodynamik Grundlagen Lennart Schmidt 08.09.2011 Inhaltsverzeichnis 1 Grundlagen 3 1.1 Temperatur und Wärme............................ 3 1.2 0. und 1. Hauptsatz..............................
Wärmestrahlung. Einfallende Strahlung = absorbierte Strahlung + reflektierte Strahlung
 Wärmestrahlung Gleichheit von Absorptions- und Emissionsgrad Zwei Flächen auf gleicher Temperatur T 1 stehen sich gegenüber. dunkelgrau hellgrau Der Wärmefluss durch Strahlung muss in beiden Richtungen
Wärmestrahlung Gleichheit von Absorptions- und Emissionsgrad Zwei Flächen auf gleicher Temperatur T 1 stehen sich gegenüber. dunkelgrau hellgrau Der Wärmefluss durch Strahlung muss in beiden Richtungen
Formelsammlung. Experimentalphysik II. Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester Pascal Del Haye 27.
 Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Klausur Wärmelehre E2/E2p SoSe 2016 Braun. Formelsammlung Thermodynamik
 Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Kapitel IV Wärmelehre und Thermodynamik
 Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Wärme und Wärmekapazität c) Das ideale Gas - makroskopisch d) Das reale Gas / Phasenübergänge e) Das ideale Gas mikroskopisch f) Hauptsätze und
Kapitel IV Wärmelehre und Thermodynamik a) Definitionen b) Wärme und Wärmekapazität c) Das ideale Gas - makroskopisch d) Das reale Gas / Phasenübergänge e) Das ideale Gas mikroskopisch f) Hauptsätze und
Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge
 Prof. Dr. Norbert Hampp 1/7 6. Freie Energie und Freie Enthalphie / 2. Hauptsatz Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge 1. Empirischer Befund: Bei einer
Prof. Dr. Norbert Hampp 1/7 6. Freie Energie und Freie Enthalphie / 2. Hauptsatz Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge 1. Empirischer Befund: Bei einer
Thermodynamik I. Sommersemester 2012 Kapitel 4, Teil 1. Prof. Dr.-Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 4, Teil 1 Prof. Dr.-Ing. Heinz Pitsch Kapitel 4, Teil 1: Übersicht 4 Zweiter Hauptsatz der Thermodynamik 4.1Klassische Formulierungen 4.1.1Kelvin-Planck-Formulierung
Thermodynamik I Sommersemester 2012 Kapitel 4, Teil 1 Prof. Dr.-Ing. Heinz Pitsch Kapitel 4, Teil 1: Übersicht 4 Zweiter Hauptsatz der Thermodynamik 4.1Klassische Formulierungen 4.1.1Kelvin-Planck-Formulierung
Physik I Mechanik der Kontinua und Wärmelehre Thomas Schörner-Sadenius
 Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Physik I Mechanik der Kontinua und Wärmelehre Thomas Universität Hamburg Wintersemester 2014/15 ORGANISATORISCHES Thomas : Wissenschaftler (Teilchenphysik) am Deutschen Elektronen-Synchrotron (DESY) Kontakt:
Die innere Energie and die Entropie
 Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
Thermodynamik I Formeln
 Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Mitschrift Thermodynamik
 Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Thermodynamik I - Übung 6. Nicolas Lanzetti
 Thermodynamik I - Übung 6 Nicolas Lanzetti Nicolas Lanzetti 06.11.2015 1 Heutige Themen Zusammenfassung letzter Woche; Zweiter Hauptsatz der Thermodynamik; Halboffene Systeme; Reversible und irreversible
Thermodynamik I - Übung 6 Nicolas Lanzetti Nicolas Lanzetti 06.11.2015 1 Heutige Themen Zusammenfassung letzter Woche; Zweiter Hauptsatz der Thermodynamik; Halboffene Systeme; Reversible und irreversible
Thermodynamik. Thermodynamics. Markus Arndt. Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008
 Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Thermodynamik Thermodynamics Markus Arndt Quantenoptik, Quantennanophysik und Quanteninformation Universität Wien January 2008 Die Hauptsätze der Thermodynamik & Anwendungen in Wärmekraft und Kältemaschinen
Ferienkurs - Experimentalphysik 2
 Technische Universität München Department of Physics Ferienkurs - Experimentalphysik 2 Wärmelehre Qi Li 22/08/2012 Inhaltsverzeichnis Inhaltsverzeichnis 1 Wärmelehre 1 2 Das ideale Gas 1 3 Nullter Hauptsatz
Technische Universität München Department of Physics Ferienkurs - Experimentalphysik 2 Wärmelehre Qi Li 22/08/2012 Inhaltsverzeichnis Inhaltsverzeichnis 1 Wärmelehre 1 2 Das ideale Gas 1 3 Nullter Hauptsatz
Moderne Theoretische Physik IIIa WS 18/19
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik IIIa WS 18/19 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 2 Dr. Stefan Rex Besprechung: 06.11.2018
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik IIIa WS 18/19 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 2 Dr. Stefan Rex Besprechung: 06.11.2018
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Klausur: :30
 Klausur: 5.12. 14-15:30 15:30 Anmeldung: Bitte heute in Listen eintragen! Zur Klausur darf ein beid- seitig handgeschriebenes Din A4 Blatt mitgenom- men werden Wärmeleitungsgleichung: A Φ = λ T l Wärmeleitung
Klausur: 5.12. 14-15:30 15:30 Anmeldung: Bitte heute in Listen eintragen! Zur Klausur darf ein beid- seitig handgeschriebenes Din A4 Blatt mitgenom- men werden Wärmeleitungsgleichung: A Φ = λ T l Wärmeleitung
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Hochschule Düsseldorf University of Applied Sciences. 13. April 2016 HSD. Energiespeicher. Thermodynamik
 13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
8.3 Hauptsätze der Thermodynamik Der erste Hauptsatz (Energieerhaltung)
 Experimentalphysik I ortmund S0/ Shaukat Khan @ - ortmund. de Kapitel 8 8. Hauptsätze der hermodynamik 8.. er erste Hauptsatz (Energieerhaltung) Zunahme an innerer Energie = zugeführte ärmemenge + zugeführte
Experimentalphysik I ortmund S0/ Shaukat Khan @ - ortmund. de Kapitel 8 8. Hauptsätze der hermodynamik 8.. er erste Hauptsatz (Energieerhaltung) Zunahme an innerer Energie = zugeführte ärmemenge + zugeführte
EP Vorlesung 15. II) Wärmelehre
 EP Vorlesung 15 II) Wärmelehre 14.Hauptsätze der Wärmelehre 15.Wärmetransprot und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion Versuche: Mechanisches Wärmeäquivalent Lufttisch
EP Vorlesung 15 II) Wärmelehre 14.Hauptsätze der Wärmelehre 15.Wärmetransprot und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion Versuche: Mechanisches Wärmeäquivalent Lufttisch
Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System
 Was Sie im letzten Lehrabschnitt gelernt haben 1 Einordnen von thermodynamischen Prozessen Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System Aussage und mathematische Formulierung
Was Sie im letzten Lehrabschnitt gelernt haben 1 Einordnen von thermodynamischen Prozessen Berechnung von Zustandsgrößen für ideale Gas im geschlossenen und offenen System Aussage und mathematische Formulierung
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Übungen zur Theoretischen Physik F SS Ideales Boltzmann-Gas: ( =25 Punkte, schriftlich)
 Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Übungen zur Theoretischen Physik F SS 2016 Prof. Dr. A. Shnirman Blatt 2 Dr. B. Narozhny, Dipl.-Phys. P. Schad Lösungsvorschlag
Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Übungen zur Theoretischen Physik F SS 2016 Prof. Dr. A. Shnirman Blatt 2 Dr. B. Narozhny, Dipl.-Phys. P. Schad Lösungsvorschlag
Umweltphysik / Atmosphäre V1: Strahlungsbilanz Erde WS 2011/12
 Umweltphysik / Atmosphäre V1: Strahlungsbilanz Erde WS 2011/12 - System Erde- Sonne - Strahlungsgesetze - Eigenschaften strahlender Körper - Strahlungsbilanz der Erde - Albedo der Erde - Globale Strahlungsbilanz
Umweltphysik / Atmosphäre V1: Strahlungsbilanz Erde WS 2011/12 - System Erde- Sonne - Strahlungsgesetze - Eigenschaften strahlender Körper - Strahlungsbilanz der Erde - Albedo der Erde - Globale Strahlungsbilanz
4 Hauptsätze der Thermodynamik
 I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
Repetitorium. Thermodynamik. 3., überarbeitete und ergänzte Auflage. von. Wilhelm Schneider. unter Mitarbeit von. Stefan Haas und Karl Ponweiser
 Repetitorium Thermodynamik 3., überarbeitete und ergänzte Auflage von Wilhelm Schneider unter Mitarbeit von Stefan Haas und Karl Ponweiser Oldenbourg Verlag München Inhaltsverzeichnis 1 Grundbegriffe 1
Repetitorium Thermodynamik 3., überarbeitete und ergänzte Auflage von Wilhelm Schneider unter Mitarbeit von Stefan Haas und Karl Ponweiser Oldenbourg Verlag München Inhaltsverzeichnis 1 Grundbegriffe 1
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 04. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 04. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 04. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 04. 06.
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #15 am 01.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #15 am 01.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt
 1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie
 Sommer-Semester 2011 Moderne Theoretische Physik III Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Di 09:45-11:15, Lehmann HS 022, Geb 30.22 Do 09:45-11:15,
Sommer-Semester 2011 Moderne Theoretische Physik III Statistische Physik Dozent: Alexander Shnirman Institut für Theorie der Kondensierten Materie Di 09:45-11:15, Lehmann HS 022, Geb 30.22 Do 09:45-11:15,
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
E2: Wärmelehre und Elektromagnetismus 7. Vorlesung 30.04.2018 Heute: - 2. Hauptsatz - Boltzmann-Verteilung https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 30.04.2018 Prof. Dr. Jan Lipfert
Proseminar: Theoretische Physik. und Astroteilchenphysik. Fermi- und Bose Gase. Thermodynamisches Gleichgewicht
 Proseminar: Theoretische Physik und Astroteilchenphysik Thermodynamisches Gleichgewicht Fermi- und Bose Gase Inhalt 1. Entropie 2. 2ter Hauptsatz der Thermodynamik 3. Verteilungsfunktion 1. Bosonen und
Proseminar: Theoretische Physik und Astroteilchenphysik Thermodynamisches Gleichgewicht Fermi- und Bose Gase Inhalt 1. Entropie 2. 2ter Hauptsatz der Thermodynamik 3. Verteilungsfunktion 1. Bosonen und
2. Hauptsatz der Thermodynamik
 Clausius (850): Wärme kann nie von selbst von einem Körper niederer emperatur auf einen Körper höherer emperatur übergehen Planck (905): Es ist unmöglich, eine periodisch arbeitende Maschine zu konstruieren,
Clausius (850): Wärme kann nie von selbst von einem Körper niederer emperatur auf einen Körper höherer emperatur übergehen Planck (905): Es ist unmöglich, eine periodisch arbeitende Maschine zu konstruieren,
5. Zweiter Hauptsatz der Thermodynamik 5.1 Reversible und irreversible Prozesse 5.2 Formulierung des zweiten Hauptsatzes
 5.1 5. Zweiter Hauptsatz der hermodynamik 5.1 Reversible und irreversible Prozesse Stoss zweier Billardkugeln: vorwärts und rückwärts laufender Film ist physikalisch sinnvoll, vom Betrachter nicht zu unterscheiden
5.1 5. Zweiter Hauptsatz der hermodynamik 5.1 Reversible und irreversible Prozesse Stoss zweier Billardkugeln: vorwärts und rückwärts laufender Film ist physikalisch sinnvoll, vom Betrachter nicht zu unterscheiden
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 ladimir Dyakonov #0 am 4.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 ladimir Dyakonov #0 am 4.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & B.M. Mladek (E136) Statistische Physik I Kapitel 2 5. März 2012 1 / 25 2.1 Grundbegriffe
Carnotscher Kreisprozess
 Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
Carnotscher Kreisprozess (idealisierter Kreisprozess) 2 p 1, V 1, T 1 p(v) dv > 0 p 2, V 2, T 1 Expansionsarbeit wird geleistet dq fließt aus Wärmebad zu dq > 0 p 2, V 2, T 1 p(v) dv > 0 p 3, V 3, T 2
11. Wärmetransport. und Stoffmischung. Q t. b) Wärmeleitung (ohne Materietransport)
 11. Wärmetransport und Stoffmischung b) Wärmeleitung (ohne Materietransport) Wärme(energie) Q wird durch einen Wärmeleiter (Metall) der Querschnittsfläche A vom wärmeren zum kälteren transportiert, also
11. Wärmetransport und Stoffmischung b) Wärmeleitung (ohne Materietransport) Wärme(energie) Q wird durch einen Wärmeleiter (Metall) der Querschnittsfläche A vom wärmeren zum kälteren transportiert, also
Wissenschaft öffentlich machen
 Wissenschaft öffentlich machen Allgemeinverständliche öffentliche Vorträge zur Astronomie und Astrophysik Heinrich-Plett-Str. 40, Kassel, Oberzwehren Gebäude AVZ, Hörsaal 298, Uni Kassel Samstag, 14.11.2015,
Wissenschaft öffentlich machen Allgemeinverständliche öffentliche Vorträge zur Astronomie und Astrophysik Heinrich-Plett-Str. 40, Kassel, Oberzwehren Gebäude AVZ, Hörsaal 298, Uni Kassel Samstag, 14.11.2015,
Isotherme 3. 4 Adiabate 2 T 1. Adiabate Isotherme T 2. Arbeit nach außen = eingeschlossene Kurve
 Carnotscher Kreisprozess Carnot Maschine = idealisierte Maschine, experimentell nicht gut zu realisieren. Einfacher Kreisprozess aus zwei isothermen und zwei adiabatischen Zustandsänderungen. Arbeit nach
Carnotscher Kreisprozess Carnot Maschine = idealisierte Maschine, experimentell nicht gut zu realisieren. Einfacher Kreisprozess aus zwei isothermen und zwei adiabatischen Zustandsänderungen. Arbeit nach
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
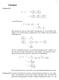 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
