Grundlagen der Physikalischen Chemie für das Lehramt
|
|
|
- Karsten Gärtner
- vor 7 Jahren
- Abrufe
Transkript
1 Grundlagen der Physikalischen Chemie für das Lehramt orlesungsscrit Ernst-Peter Röth ersion.
2
3 3 Inhaltsverzeichnis orbesrechung. Gase und Elektrolyte. Definitionen. Gasgesetze.3 Elektrolyte.4 Das Oswald sche erdünnungsgesetz. Mathematische Grundlagen. Differentiale. Integralrechnung 3. Der erste Hautsatz der Wärmelehre 3. Die Innere Energie 3. Die Enthalie 3.3 Die molare Wärmekaazität 3.4 Adiabatische Prozesse 3.5 Der Carnot-Prozeß 4. Der zweite Hautsatz der Wärmelehre 4. Die Entroie 4. Die Richtung sontan ablaufender Prozesse 4.3 Der Wirkungsgrad des Carnot-Prozeß 4.4 Die Freie Enthalie und die Helmholtz-Energie 4.5 Das chemische Potential
4 4 5. Mehrkomonenten-Systeme 5. Phasen und Freiheitsgrade 5. Die Clausius-Claeyron Gleichung 5.3 Mehrkomonentensysteme und Mischungen 5.4 Oberflächen 5.4. Die Oberflächensannung 5.4. Festköreroberflächen 5.5 Gefrierunkterniedrigung und Siedeunkterhöhung 6. hermochemie 6. Die Standardenthalie und der Satz von Hess 6. Die Reaktionswärme 6.3 Der Dissoziationsgrad von Wasserdamf 6.4 Die emeraturabhängigkeit der Gleichgewichtskonstanten und das Prinzi von Le Chatelier 7. Elektrochemie 7. Die Leitfähigkeit 7. Die Elektromotorische Kraft 7.3 Elektrochemische Bestimmung thermodynamischer Größen 7.3. Bestimmung des Aktivitätskoeffizienten 7.3. Bestimmung der Gleichgewichtskonstanten Bestimmung des Löslichkeitsrodukts Bestimmung von Zustandsfunktionen
5 5 8. Kinetik 8. Die Stoßzahl 8. Die Reaktionsgeschwindigkeit 8.3 Die Geschwindigkeitskonstante 8.4 Reaktionssysteme 8.5 Die Reaktionsordnung 9. Atom-Modelle 9. Die Strahlungsgesetze 9. Die Rydberg-Formel 9.3 Der Photoelektrische Effekt 9.4 Der Comton-Effekt 9.5 Atom-Modelle 9.6 Die Wellennatur der Materie 9.7 Die Schrödinger-Gleichung. Moleküle und Kristalle. Die Bindung durch Coulomb-Kräfte. an der Waals-Bindungen.3 Kristallbindungen.3. Molekül-Kristalle.3. Atom-Kristalle
6 6
7 7 orbesrechung Plan der Lehrveranstaltung Da innerhalb von nur einem Semester die gesamte Physikalische Chemie behandelt werden muß, ist eine Beschränkung auf einen Überblick über die wichtigsten hemen vorgegeben. Dabei muß auf die seziellen Anforderungen des Lehramtes Rücksicht genommen werden. In der Schule wird die Physikalische Chemie nur im geringen Maße im Rahmen des Chemie-Unterrichts gelehrt. Da sie jedoch das Grundgerüst der heorie der Chemie bildet, ist für den Lehrer ein erständnis der grundlegenden Gleichungen und der Denkweise der Physikalischen Chemie unabdingbar. Daher soll das Ziel dieser orlesung das Erarbeiten der wichtigsten Grundbegriffe der Physikalischen Chemie und ihrer Bedeutung sein. Die Einsicht in die Natur der Materialien und der Prozesse vertieft sich mit fortschreitender Zeit und entsrechend veraltet Lehrbuchwissen. Daher ist es notwendig, lebenslang zu lernen, was für Lehrerinnen und Lehrer nichts anderes heißt, als sein eigenes Wissen ständig zu überrüfen. Dazu braucht man aber besonders viel Können, da das Wissen veraltet. Das bedeutet aber für die orlesung, dass sie nicht vorrangig Lehrbuchwissen räsentieren sollte, sondern dieses Lehrbuchwissen hinterfragen soll. Die Einführung in die Physikalische Chemie soll dabei insbesondere auf die Erfordernisse des gleichzeitig stattfindenden Praktikums und der Übungen eingehen. Außerdem muß, da für die Studierenden des Lehramts Sek I nur diese Lehrveranstaltungen der Physikalischen Chemie in der Studienordnung vorgesehen sind, das gesamte Gebiet behandelt werden. Ausgehend von diesen oraussetzungen habe ich für die -stündige orlesung folgende, mir wichtig erscheinende Punkte herausgegriffen : Einleitung :. Gase und Elektrolyte : Definitionen und Begriffe. Differentiale, Zustandsgrößen und wegabhängige Prozesse hermodynamik : 3. Der. Hautsatz der Wärmelehre : Die Enthalie 4. Der. Hautsatz der Wärmelehre : Die Entroie 5. Phasen und Stoffgemische 6. hermochemie : Gleichgewicht und chemisches Potential 7. Elektrochemie als Anwendung der hermodynamik in der Schule
8 8 Kinetik : 8. Formalkinetik : Reaktionsgeschwindigkeit und Reaktionskonstante Aufbau der Materie : 9. Atom-Modelle : Der Weg zur Schrödinger Gleichung. Moleküle und Kristalle : Die chemische Bindung Die Physikalische Chemie ist eine relativ abstrakte Wissenschaft. Es werden allgemeine Gesetze abgeleitet, die für ganze Klassen von Stoffumsätzen gelten. Dabei werden Begriffe definiert, die entweder in der Umgangssrache gar nicht vorkommen, wie z.b. die Entroie, oder aber dort unsezifische Bedeutungen haben (Kraft, Wärme, etc). In der orlesung wollen wir uns auf die ermittlung der Gedankengänge und der Definitionen der Physikalische Chemie beschränken. In der Diskussion der einzelnen hemenkreise möchte ich auch insbesondere auf Fragen zur Didaktik, d.h. zur ermittlung des Stoffes eingehen. Beisiele aus dem hemenkreis können in dieser Lehrveranstaltung nicht vorgestellt werden. Dies wird dann für die Studierenden der Sekundarstufe II der Schwerunkt im Hautstudium sein. Für die Präsentation des Stoffes wollen wir mit so wenig Rechnen wie möglich auskommen, da nicht die Ableitung einer Gleichung für das erständnis wichtig ist, sondern die Bedeutung der eingehenden Größen und ihrer erknüfungen. Wir wollen also im Sinn von Richard Feynman eine Formel als die Beziehung zwischen hysikalischen und chemische Größen, die durch ihre Symbole dargestellt sind, verstehen und nicht als algebraische Rechenvorschrift, die angibt, wie eine Größe in eine andere umgerechnet wird. Wie bereits erwähnt, handelt es sich bei unserem hema um abstrakte Gedankengänge. Anders als in den meisten anderen Fachgebieten der Chemie werden nicht bestimmte Stoffe oder Reaktionen betrachtet, sondern es werden die Gesetze vorgestellt, die den realen Substanzen ihre Eigenschaften verleihen, beziehungsweise die den Ablauf von chemischen Prozessen steuern. Damit stellt diese Lehrveranstaltung eine gewisse intellektuelle Herausforderung dar, von der ich hoffe, daß Sie sie annehmen werden. Im wesentlichen werden die folgenden Schritte zum erständnis des Unterrichtsstoffes notwendig sein :. Reduktion eines komlexen Prozesses auf den Einzelschritt. Abstraktion vom realen Exeriment Gedankenexeriment 3. Übertragung der Erkenntnis auf die Anforderungen im Schulunterricht
9 9 Es gilt : erstanden hat man erst dann, wenn man den Stoff wiedergeben kann. ersuchen Sie doch, bis zur nächsten Stunde einmal zu definieren, was ein Gas ist. Sie werden sehen, daß eine so triviale Definition zu recht komlexen Überlegungen führt. Literatur zu einer orlesung "Physikalische Chemie für das Lehramt" kann nicht angegeben werden. Insbesondere nicht zu dieser Lehrveranstaltung, da es eines meiner Ziele ist, Ihr Interesse für das Fachgebiet zu wecken und Sie zu befähigen und ermuntern, auch die Lehrbücher, egal ob für Schule oder Hochschule gedacht, kritisch zu lesen. Bei der orbereitung der Lehrveranstaltung habe ich im wesentlichen folgende Bücher benutzt : P.W. Atkins Kurzlehrbuch Physikalische Chemie G. M. Barrow "Physikalische Chemie I, II, III" P. W. Atkins "Physikalische Chemie" B. Harder "Einführung in die Physikalische Chemie" K. J. Laidler "Reaktionskinetik I" H. R. Christen Struktur und Energie Dies ist nur ein kleiner Auszug aus der ielzahl von Lehrbüchern der Physikalischen Chemie. Im Grunde ist es gleichgültig, welches Buch Sie benutzen, da alle die Grundlagen, wie wir sie besrechen werden, erläutern. Als Formelsammlung für die wenigen mathematischen Ableitungen schlage ich vor : K. Rottmann "Mathematische Formelsammlung" oder irgend eine andere Formelsammlung der Mathematik, die Integraltafeln enthält.
10 . Gase und Elektrolyte. Definitionen Die Physikalische Chemie versucht Aussagen zu machen, die über die Einzelbeobachtung hinausgehen und für eine ganze Klasse von orgängen richtig sind. Zur Beschreibung solcher Aussagen müssen Begriffe gewählt werden, die unmißverständlich sind. Damit sie dies aber sind, müssen sie eindeutig definiert werden. Zuerst soll die beobachtete Größe von ihrem Umfeld unterschieden werden. Die beobachtete Größe ist das System, alles was nicht zum System gehört, ist die Umgebung System / Umgebung Das System muß für jede Betrachtung klar beschrieben werden. Es steht immer mit seiner Umgebung in einer vorgegebenen Beziehung. Für jetzt sollen die folgenden Beziehungen definiert werden (Abbildung ) :
11 . Ein offenes System kann mit seiner Umgebung sowohl Masse als auch Energie austauschen. M # const E # const. Ein geschlossenes System läßt nur noch den Energieaustausch zu. M const E # const 3. Bei einem isolierten System ist sowohl der Masse- als auch der Energieaustausch unterbunden. M const E const Die Beschreibung von Systemen bei vorgegebenen Bedingungen ist eines der Aufgabengebiete der Physikalischen Chemie. Darüber hinaus werden orgänge beschrieben, die eine eränderung des Systems bewirken. Um auch über diese Prozesswege klare Aussagen machen zu können, werden sie eingeteilt in :. isochore Prozesse, bei denen das olumen konstant bleibt.. isobare Prozesse, bei denen der Druck konstant bleibt. 3. isotherme Prozesse, die bei konstanter emeratur ablaufen. Selbstverständlich gibt es noch eine ganze Reihe weiterer Prozesswege, einige davon werden wir im erlaufe der orlesung kennenlernen. Für unsere Betrachtungen heute genügen aber diese drei. Im nächsten Schritt soll der Aggregatzustand des Systems festgelegt werden. In der Alltagssrache unterscheidet man Gase, Flüssigkeiten und Feststoffe. Im wissenschaftlichen Bereich müssen diese Begriffe genau definiert werden, um im Zweifelsfall (Hüfgummi) eine Zuordnung treffen zu können.. Feststoffe haben ein festes olumen und eine feste Form. Flüssigkeiten haben ebenfalls ein festes olumen, können aber jede Form (des Gefäßes) annehmen 3. Gase haben weder ein festes olumen noch eine feste Form. Sie erfüllen jedes vorgegebene olumen Damit ist aber noch nicht klar, was z.b. ein Gas ist. Diese Definitionen beziehen sich nur auf die Eigenschaften der Stoffe. Im erlaufe der orlesung werden wir lernen, worauf diese Eigenschaften der Aggregatzustände zurückzuführen sind und dabei erkennen,
12 dass Gase und Flüssigkeiten eigentlich gar nicht so genau voneinander zu unterscheiden sind. Letztendlich müssen die Aggregatzustände über die Moleküleigenschaften definiert werden... Gasgesetze Im folgenden wollen wir uns zuerst den Gasen zuwenden, dies vor allem deshalb, weil ein Gas in erster Näherung ein System von eilchen darstellt, die vollständig unabhängig voneinander sind. Ein solches System ist ungeordnet und die Bewegung der eilchen ist regellos. Das System hat damit den orteil, daß in ihm sehr einfache Regeln der Statistik gelten. Die Eigenschaften von Gasen waren schon immer Gegenstand von Überlegungen und Untersuchungen. So ist es nicht verwunderlich, daß mit Beginn der modernen Naturwissenschaften auch schon Gasgesetze entdeckt wurden. 66 haben der Engländer Robert Boyle und (unabhängig davon) 679 der Franzose Edme Mariotte herausgefunden, daß der Druck und das olumen eines Gases zueinander umgekehrt roortional sind, wenn die emeratur des Systems konstant gehalten wird. / oder * const Dieses Gesetz bedeutet aber nicht nur, dass das Produkt von Druck und olumen konstant ist. Es muß vielmehr eine Energie * geben, die sich nicht ändert. Bei einer emeratur von C ist der Wert der Proortionalkonstanten gleich, l*bar, wenn sich Mol des Gases im olumen befindet.
13 3 Bei den ersuchen von Boyle und Mariotte wurde die emeratur des Gases festgehalten. Man wußte aber bereits, daß Wärme die Festkörer und Flüssigkeiten ausdehnt. So wurden bereits in der Antike feste erbindungen dadurch hergestellt, daß das äußere eil erhitzt wurde und sich beim Erkalten fest um das innere eil zusammenzog (Aufschrumfen). Es stellt sich also die Frage : Wie verhalten sich Gase bei emeraturänderung? Die entsrechenden ersuche wurden um 8 von dem Franzosen Louis Joseh Gay- Lussac durchgeführt. Er fand heraus, daß der Ausdehnungskoeffizient α für alle Gase gleich groß ist. Bei isobaren orgängen gilt : α o / C t 73.6 Der Index o bei α und weist auf die Standardbedingungen 3 hpa und C hin und t ist die emeraur in C. Da ist, gilt das. Gay-Lussac sche Gesetz : ( + t) α oder t t also α mit t Die neue emeraturskala wird als absolute emeratur bezeichnet und erhält die Einheit Kelvin (K). Aus dem. Gay-Lussac schen Gesetz geht hervor, daß es keine negativen Werte von geben kann. Wir werden im folgenden fast ausschließlich diese absolute emeratur benutzen.
14 4 Hält man das olumen konstant, so findet man bei emeraturänderung den isochoren Sannungskoeffizienten β : β / t 73.6 C Analog zum Isobarengesetz ergibt sich das.gay-lussac sche Gesetz zu β Neben dem Ausdehnungskoeffizienten α und dem Sannungskoeffizienten β wird der isotherme Komressionskoeffizient κ definiert : κ / (Das Minuszeichen wurde eingeführt, damit κ ositiv ist.) Das Boyle-Mariotte sche Gesetz und die Gesetze von Gay-Lussac lassen sich zum Allgemeinen Gasgesetz zusammenfassen : bei : x x : x
15 5 Da α / ist, gilt nach dem Einsetzen von x : oder const Die Konstante ist noch abhängig von der Molzahl n und der Allgemeinen Gaskonstante R : nr oder n R Die Allgemeine Gaskonstante R hat den Wert R 8,34 J / mol K Im Allgemeinen Gasgesetz wird die Energie der thermischen Energie n R gleichgesetzt. Die Bedeutung dieser Beziehung wird uns säter noch beschäftigen. Aus dem Allgemeinen Gasgesetz folgt unmittelbar das Gesetz von Avogadro, denn es läßt sich umformen in n R Dies heißt aber nichts anderes, als daß bei festem, und die Molzahl n eine Konstante ist. atsächlich ist das Avogadro sche Gesetz älter als das Allgemeine Gasgesetz.
16 6.3 Elektrolyte Mit Gasen beschäftigen wir uns, weil die Gasartikel raktisch unabhängig voneinander sind. In Flüssigkeiten gilt diese Unabhängigkeit nicht mehr, da die Packung der Atome und Moleküle zu dicht wird. Nur wenn wenige Partikel sich in einem Bad anderer Moleküle bewegen, gelten wieder ähnliche Gesetze wie die für Gase. Einen solchen Fall, nämlich Elektrolyte, wollen wir im folgenden betrachten. Elektrolyte sind Lösungen von Ionen, d.h. geladener eilchen, in einer Flüssigkeit, wobei wir uns auf wäßrige Lösungen beschränken wollen. Ist die Lösung genügend verdünnt, und das soll vorausgesetzt werden, so verhalten sich die Ionen in der Flüssigkeit wie searate eilchen. Die Beweglichkeit von Ionen ist gegenüber der von Gasartikeln aber erheblich eingeschränkt, da sie von einer Hydrathülle umgeben sind. Damit sind die Ionen normalerweise sehr groß im ergleich mit Gasteilchen. Aufgrund der elektrostatischen Anziehung zwischen den geladenen Ionen und den Diolen des Wassermoleküls lagern sich letztere um die Ionen herum an. Eine tyische Anzahl solcher angelagerten Wassermoleküle ist, wobei aber zu beachten ist, daß die Wechselwirkung mit zunehmenden Abstand vom Zentralion abnimmt. Die Hydrathülle sorgt auch dafür, daß ungleichnamige Ionen normalerweise nicht rekombinieren. Nur bei kleinen Ionen, die aus Platzgründen nur eine geringe Zahl von Wassermolekülen um sich herum lagern können, kommen sich die entgegengesetz geladenen Ionen nahe genug, um sich zu einem Salz zusammenzulagern. In diesem Fall ist die Coulomb-Kraft groß genug, um die Wasserdiole zu verdrängen.
17 7 Einschub : Das Coulomb-Gesetz : Zwei geladene Körer (also auch die Ionen) üben aufeinander eine Kraft F aus, die roortional zu dem Produkt der Ladungen und umgekehrt roortional zum Quadrat des Abstands zwischen ihnen ist : F Q 4πε Q r 4 πε z q z q r Hierbei sind Q i die Gesamtladungen z*q eines Körers, q die Elementarladung und ε 8.854* - J - C m - die Dielektrizitätskonstante des akuums. In Wasser muß diese Größe noch mit der relativen Dielektrizitätskonstante des Wassers ε 8. multiliziert werden. Das Coulomb-Potential, d.h. die otentielle Energie zwischen den beiden Ladungen, ist entsrechend der Definition Energie Kraft * Weg : Q Q 4 πε r Die otentielle Energie entsricht der Arbeit, die geleistet werden muß, um zwei Ladungen Q und Q aus dem Unendlichen auf den Abstand r zu bringen. Bei einem Diol heben sich die entgegengesetzten Kräfte eines Ladungsträgers auf seine beiden Enden nicht auf, wenn die Abstände verschieden sind. F Q+ Q 4 πε r Q Q r
18 8 Einschub : Das Ohm sche Gesetz Ladungsträger, die sich in einem elektrischen Feld befinden, bewegen sich auf den entgegengesetzt geladenen Pol zu. Die Bewegung wird durch das Gesetz von Ohm bestimmt : I /R U U ist die antreibende Kraft, die Potentialdifferenz oder elektrische Sannung, /R ist die Proortionalitätskonstante (R elektrischer Widerstand und der Kehrwert /R ist die Leitfähigkeit). Die elektrische Stromstärke I ist die ro Zeiteinheit transortierte Ladung : I n q / t Der Widerstand eines Leiters (z.b. einer Elektrolyt-Lösung) ergibt sich aus dem sezifischen Widerstand ρ, der Länge des Leiters l und seinem Querschnitt σ zu R ρ l σ Während die Bewegung von ungeladenen Gasartikeln nicht beeinflußt werden kann, werden die geladenen Ionen durch elektrische (und magnetische) Felder abgelenkt. Bringt man eine Elektrolyt-Lösung, die selbst elektrisch neutral ist, in ein elektrisches Feld, so werden die Ladungsträger getrennt. Diese rennung ist der erste Schritt der Elektrolyse. Alle weiteren Schrittte, insbesondere die Elektrodenreaktionen, sind normale chemische Prozesse : Salzsäure besteht aus ositiv geladenen H-Ionen und negativen Cl-Ionen. Bringt man zwei Elektroden in die Salzsäure und legt an diese eine Sannung an, so werden die H + und Cl - Ionen getrennt. An den Elektroden finden folgende Prozesse statt (Abbildung ) :
19 9 Kathode : H + + e H Anode : Cl - - e Cl H + H H Cl + Cl Cl Einschub : Definition von Anode und Kathode Im äußeren Stromkreis gilt : Die Elektronen fließen von der Anode zur Kathode. Die Kathode lädt sich bei Anschluss einer Sannungsquelle also negativ auf, die Anode wird ositiv. Im Elektrolyten wird definiert : Die Anode nimmt negative Ladung aus der Lösung auf, die Kathode gibt negative Ladung an die Lösung ab. Die Aufnahme eines Elektrons wird als Reduktion, die Abgabe als Oxidation bezeichnet. Der gesamte Prozeß ist dann eine Redox-Reaktion. Damit Ladungen getrennt werden können (Elektrolyse) muss ein elektrisches Feld erzeugt werden, in dem die Anode ositiv, die Kathode negativ gehalten (!) wird. Bei sontanen Prozessen (galvanische Zelle) baut sich ein lokales Feld auf, es gibt ohne äußere Überbrückung der Elektroden keine Ionenwanderung in der Lösung. Die Umkehrung der Elektrolyse ist die galvanische Zelle. Hier gehen aufgrund von Elektrodenreaktionen Ionen in Lösung und es baut sich zwischen den Elektroden eine Sannung auf. Diese Zellsannung wird als Elektromotorische Kraft EMK bezeichnet.
20 Diese Bezeichnung stammt noch aus dem 9.Jahrhundert, als jeder Antrieb als Kraft bezeichnet wurde. Im heutigen Sinne ist die EMK keine Kraft. Die EMK hängt von den Konzentrationen der Produkte und Edukte der Bruttoreaktion ab : E E R nf Π ln Π [ Pr odukte] [ Edukte] E ist die EMK, E die EMK unter Normalbedingung. Die Faraday-Konstante F ist die molare Ladung : F N A q e As/mol. Die Größe n ist die bei der Reaktion übertragene Zahl der Elektronen. Diese Nernst sche Gleichung soll hier unkommentiert stehen bleiben. Im Abschnitt zur Elektrochemie wird sie mit den thermodynamischen Größen der Reaktion in Beziehung gebracht..4 Das Oswald sche erdünnungsgesetz Wie bereits oben gesagt, sind Elektrolyte wäßrige Lösungen von Ionen. Sie werden hergestellt, indem Salze in Wasser gelöst werden. Salze bestehen bereits im festen Zustand aus Ionen. Salzlösungen werden als wahre Elektrolyte bezeichnet, da ihre Ausgangssubstanz bereits in ionischer Form vorliegt. Im Gegensatz zu Salzen besitzen Gasmoleküle immer eine kovalente Bindung, sie bestehen also nicht aus Ionen. Löst man jedoch z.b. Chlorwasserstoff in Wasser, indem man einen Gasstrom durch das Lösungsmittel erlen läßt, so findet eine chemische Reaktion statt, bei der solvatisierte Ionen entstehen. Für die Lösung von Chlorwasserstoff gilt : HCl(g) HCl(aq) Cl - (aq) + H + (aq) Da der Ausgangsstoff nicht in Ionenform vorliegt, bei Lösung aber Ionen bildet, wird er als otentieller Elektrolyt bezeichnet.
21 Desweiteren unterscheidet man starke und schwache Elektrolyte. Diese Unterscheidung richtet sich nach den Dissoziationsgrad des Gelösten. Als Dissoziationsgrad α wird das erhältnis der gebildeten Ionen zur Einwaage bezeichnet. α [ Ionen] [ Einwaage] Löst man zum Beisiel Kochsalz, so wird die gesamte Einwaage in Ionen überführt, der Dissoziationsgrad ist also. Bei schwachen Elektrolyten, wie z.b. der Essigsäure, bleibt der größte eil der Einwaage in der undissozierten Form erhalten, der Dissoziationsgrad ist dann sehr viel kleiner als. HAc α H + + α Ac - Für die Gleichgewichtskonstante K gilt dann nach dem Massenwirkungsgesetz : K + [ H ] [ Ac ] [ HAc] α [ HAc] α[ HAc] ( α) [ HAc] Da α << ist, kann es im Nenner gegen vernachlässigt werden. Damit ergibt sich dann für den Zusammenhang zwischen der Gleichsgewichtskonstanten und dem Dissoziationsgrad : α K [ HAc] Dies ist das Oswald sche erdünnungsgesetz für einwertige schwache Elektrolyte. Für zweiwertige Elektrolyte ergibt sich entsrechend α 3 [ ] K H Ac
22 . Mathematische Grundlagen Die Mathematik zur hermodynamik besteht fast ausschließlich aus der Umwandlung von einer Energieform in die andere. Allerdings sind diese Umwandlungen meist nicht mit den integralen Größen, sondern mit infinitesimal kleinen Werten durchzuführen, da die Gesetze der hermodynamik nur für infinitesimale Bereiche exakt gelten. Daher soll im folgenden ein Einblick in die Regeln des Rechnens mit Differentialen gegeben werden.. Differentiale Funktionen, die mehr als zwei ariable enthalten, wie z. B. die Allgemeine Gasgleichung n R die vier ariable (,, n und ) enthält, können nicht abgeleitet werden, da der Oerator der Ableitung d dx y sich er definitionem immer nur auf eine abhängige und eine unabhängige Größe bezieht. Faßt man die Ableitung gemäß ihrer Definition jedoch als Quotient zweier Differentiale auf, d dx y y lim x x dy dx mit dylim ( y) und dxlim ( x) so kann der Begriff des Differentials ohne Schwierigkeiten auf alle ariablen einer mehrdimensionalen Funktion angewendet werden.
23 3 Es soll jetzt hier ein Exkurs in die zweidimensionalen Ableitungen eingeschoben werden : Zur Definition der angente und ihrer Steigung im Punkt P(x,y) geht man über die Sekante PR und läßt den Punkt R(r,s) auf P zuwandern. Die Sekantensteigung ist gegeben durch m s y s x r und die angentensteigung durch m t lim x r y s m s Die Ableitung einer Geradengleichung ist demnach : y mx + b d dx y lim ( mx + b ) ( mx + b ) x x x x lim x x m x x x x m Für eine Potenzfunktion gilt z.b.: y ax n d dx y lim x x n n a x x x x n n n3 n ( ) lim a x + xx + x x x x x a n x n Die wichtigsten Differentiationsregeln sind die Summenregel : d ( ) dx f x g x d ( ) + ( ) dx f( x) + d dx gx ( )
24 4 die Produktregel : und die Kettenregel : d ( ) dx f x gx gx d ( ) ( ) ( ) dx f( x) + f( x) d dx gx ( ) d ( ( )) dx f g( x) d dg f( g) d dx gx ( ) Hier soll nur die Produktregel bewiesen werden d ( ) dx f( x) g( x) lim f ( x) g( x) f ( x ) g( x ) x x + lim f ( x) g( x) f ( x ) g( x) f ( x ) g( x) f ( x ) g( x ) x x lim gx ( ) f( x) f( x) x x + f( x ) gx ( ) gx ( ) x x gx ( ) d + dx f ( x) f ( x) d dx gx ( ) qed Wir gehen jetzt wieder zurück zu den mehrdimensionalen Funktionen. Gegeben sei eine Funktion mit drei eränderlichen x,y und z : z f ( x, y) deren Differential dz durch die Differentiale dx und dy und die Ableitungen von z nach x und nach y ausgedrückt werden soll. Hierbei ist zu beachten, daß, da eine Ableitung nur in einer Ebene definiert ist, diese Ebene angegeben werden muß, man führt also eine artielle Differentiation ein : d dx y y x z const. z
25 5 Der Begriff artiell ist hier redundant, da rinziiell jede Ableitung artiell ist. Im Falle der Funktion zweier ariablen sind artielle Differentiation und Differentialquotient identisch. Wie bei der Einführung der Differentiation geht man auch bei der Einführung der Differentiale von Differenzen aus, die dann gegen Null gehen : dz lim z z Gegeben seien zwei Punkte P (x',y',z') und Q (x,y,z), die beide die Funktion z f (x,y) erfüllen sollen. Gesucht ist die Differenz z z z' Diese Differenz erhält man, wenn man zuerst in der Ebene y const. nach R (x',y,z'') geht und dann in Ebene x const. weiter nach Q. ( '' ') ( '') z z z + zz z mit z'' z' y x' y und z z z' ' x für kleine x, y. x y Es gilt also : z z z y x + y x x' y
26 6 Beim Übergang zu infinitesimalen Größen geht x' x, und für das Differential von z ergibt sich dz z z dx dy + x y y x Die gleiche Formel hätte man erhalten, wenn man von P erst nach S (x,y',z''') und dann nach Q gegangen wäre. Die Definition des Differentials ist beliebig auf mehrdimensionale Funktionen erweiterbar : Für f (x i, i,..., n) gilt : df n i f x i x j i dx i Rechenregeln Berechnet man das Differential dz in der Ebene zconst., so ergibt sich, wegen dz : dz z z x y dx z + z y x dy z und daraus mit dx dy z x y z x y y z z x z x y Hierbei wurde bereits davon Gebrauch gemacht, daß man mit Differentialen wie mit Zahlen rechnen kann, vorausgesetzt, sie liegen in der gleichen Ebene : x y y z t t t z dx dy dz x dy dz dx t t t t t t
27 7. Integralrechnung Die meisten Gesetze der hermodynamik werden in der Form von Differentialgleichungen angegeben. Um mit diesen Gesetzen arbeiten zu können, z.b. um Meßergebnisse zu überrüfen, müssen die Differentiale integriert werden. Daher soll hier eine kurze Einführung in die Berechnung von Integralen gegeben werden. Die Integralrechnung ist die Umkehrung der Differentiation. Während aber der Ableitung einer Funktion eine wohl definierte mathematische orschrift zugrunde liegt, gibt es für das Integrieren keine solche orschrift. Die Berechnung eines Integrals läuft im wesentlichen immer darauf hinaus, das Ergebnis zu erraten. Dabei unterstützen Integraltafeln das Erraten. Die Rechenregeln für die Integration dienen der Umformung der Ausgangsgleichung mit dem Ziel, eine Form zu finden, die in der Integraltafel aufgeführt ist. Um eine Differentialgleichung integrieren zu können, wird zuerst dafür gesorgt, daß auf beiden Seiten der Gleichung jeweils nur eine ariable vorkommt Nach dieser rennung der ariablen erfolgt die ransformation (Umformung) auf eine Form der Integraltafel. Da bei der Integration immer eine noch unbekannte Konstante, die Integrationskonstante, eingeführt werden muß, wird diese anschließend bestimmt. Dazu benötigt man einen Punkt der Kurve. Da dieser Punkt meistens der Startwert oder der Endwert der Funktion ist, wird er Randwert genannt. Mit der Lösung des Randwertroblems ist dann die Lösung der Differentialgleichung gefunden. Ein Beisiel soll das erfahren der Integration erläutern: Aus dem Reaktionssystem A + A B () A C () Läßt sich die folgende Differentialgleichung für die Änderung der Konzentration des Eduktes A ableiten : [ A] t [ A] k [ A] k
28 8 Der erste Schritt zur Lösung ist die Searation der ariablen. k [ A] [ ] [ ] A + k A t Jetzt wird [A] durch die ariable x ersetzt. In der Integraltafel findet man das folgende Integral aufgelistet : dx ln Const ax + bx + c b ac ax + b ax + b + b b ac ac Es muß also a k b k c ersetzt werden, um die Lösung des Integrals auf der linken Seite der Gleichung zu erhalten : k[ A] [ ] A + x ln Const kx + k x k k k Das Integral der rechten Seite ist einfacher zu lösen : t t Damit ergibt sich dann als Lösung der Gleichung k ln Const k k[ A] [ A] + k t In dieser Formel ist noch die Konstante Const unbekannt. Ihren Wert erhält man aus der Randbedingung, daß zum Zeitunkt t die Konzentration von A gleich [A] sein soll. k ln Const k k[ A] [ A] + k
29 9 Nach der Multilikation mit k und dem Entlogarithmieren erhält man Const k k[ A] [ A] + k Die Konstante ist also gleich Const k [ A] + k k + k [ A] k [ A] und damit gilt für die Zeitabhängigkeit der Konzentration von A : [ A] t kt k[ A] e k t [ A] ( e ) + k k Definition : Das Kreisintegral steht für eine in sich geschlossene Folge von Einzelintegralen. erläuft z.b. der Prozess über die Zustände (Punkte im --Diagramm) A,B, C und D und wieder zurück nach A, So gilt : B A C B D C A D
30 3 3. Der erste Hautsatz der Wärmelehre 3.. Die Innere Energie Der erste Hautsatz der hermodynamik beschäftigt sich mit der Frage : Ist es möglich Energie zu erzeugen? Bevor diese Frage beantwortet werden kann, muß jedoch der Untersuchungsgegenstand definiert werden. Wir betrachten im folgenden immer ein System, in der Chemie meist ein chemischer Reaktor, also z.b. ein Becherglas oder einen Autoklaven. Dieses System trennen wir gedanklich von der Umgebung ab. Wo wir die Grenze zwischen System und Umgebung festlegen, ist willkürlich und wird je nach Aufgabenstellung anders sein. Will man einem geschlossenen System von außen Energie zuführen, so geht dies nur über Wärmezufuhr dq und/oder olumenarbeit dw -d. Durch diese Energiezufuhr ändert sich der Zustand des Systems, der durch die ariablen, und beschrieben ist. Die Energie des Zustands ändert sich dann um den Betrag du, der als Innere Energie bezeichnet wird : du dq + dw dq d Die Innere Energie ist also differentiell als Summe der von außen geleisteten Arbeit definiert. Der Absolutbetrag ist nicht bestimmbar, da ein Randwert zur Berechnung der Integrationskonstanten fehlt.
31 3 3. Die Enthalie Fragt man nach der Gesamtenergie eines Systems, so muß man zur inneren Energie noch die otentielle Energie hinzurechnen und kommt so zur Definition der Enthalie H U + Die Enthalie ist also integral definiert und ebenfalls nicht absolut bestimmbar, da U nicht bestimmbar ist. Die Definition der Enthalie ist die mathematische Formulierung des. Hautsatzes der hermodynamik. Er besagt, daß Energie weder gewonnen noch zerstört, aber in andere Formen umgewandelt werden kann. Die mathematische Formulierung ist dabei dem Energiesatz der Mechanik E gesamt E kinetisch + E otentiell analog. ( ) ist eine otentielle Energie und wir werden säter sehen, daß die Innere Energie U im wesentlichen Bewegungsenergien enthält. Einschub : zu Zustandsgröße und wegabhängiger Größe Ein Eimer mit Wasser wird vom Erdgeschoß in den ersten Stock gebracht. Dabei gewinnt er an otentieller Energie E. Geht man erst in den dritten Stock und dann erst in den ersten, so ist der Zugewinn an Energie immer noch E, da die otentielle Energie nur vom Ort (Zustand) und nicht vom Weg, auf dem der Ort erreicht wurde, abhängt. Die Arbeit, die geleistet wurde, ist aber abhängig vom Weg. Am geringsten ist sie, wenn der Eimer auf direktem Weg an seinen neuen Platz gebracht wird. Jeder Umweg bedeutet zusätzliche Arbeit, ohne das ein zusätzlicher Gewinn an Energie erhalten wird. In der hermodynamik laufen die Prozesse auf Wegen in einem,,-diagramm ab. Zustandsgrößen hängen dann nur vom Ort ( x / x / x ) ab, während wegabhängige Größen wie die Arbeit vom erlauf des Prozesses abhängen. Einem System, das vom Zustand A nach Zustand B überführt werden soll, kann unter unterschiedlichen äußeren Bedingungen Energie zugeführt werden, wobei sich dq und d unterscheiden, ihre Summe jedoch konstant ist. Die Unterschiede in der Prozeßführung, d.h. die unterschiedlichen Wege, auf denen eine Zustandsänderung durchgeführt
32 3 wird, machen es notwendig, diese Wege zu kennzeichnen. Aber da wir es im geschlossenen System mit einem dreidimensionalen Problem zu tun haben, müssen wir die Wege noch weiter einschränken. Dabei zeigt es sich, daß es nur einen Weg gibt, der umgekehrt werden kann, d.h. der reversibel ist. Säter werden wir sehen, daß für reversible Wege der Wirkungsgrad am größten ist. Auf solchen reversiblen Wegen befindet sich das System immer im Gleichgewicht. Alle nicht reversiblen Wege sind irreversibel. 3.3 Die molare Wärmekaazität Um die Wärmezufuhr eines Systems zu messen, bedient man sich der emeraturmessung, wobei eine Proortionalitätskonstante, die molare Wärmekaazität auftritt : m q C M Molmasse, m Einwaage M Da die Wärmeänderung wegabhängig ist, ist auch die Wärmekaazität C q n n Molzahl wegabhängig, wobei besonders die isochoren und die isobaren orgänge eine Rolle sielen, es wird also C und C v angegeben (C q wäre definitionsgemäß gleich Null und C unbestimmt). Da die Wärme über die Wärmekaazität und die emeraturänderung leicht zu messen ist, werden Zustandsänderungen gern durch reine Wärmezu- oder -abfuhr herbeigeführt. Ist der Prozeß isochor, ist also d gleich Null, so gilt du dq wegen du dq d und d
33 33 Für isobare orgänge ist die Wärmetönung gleich der Enthalieänderung, denn es gilt dh dq + d dq für d Da chemische orgänge häufig unter konstantem Druck durchgeführt werden (die Behälter sind offen), ist die Enthalie, die für chemische orgänge wichtigere Größe und wird daher auch anstelle der inneren Energie (die für Gashasenreaktionen wichtiger ist) in Handbüchern tabelliert. 3.4 Adiabatische Prozesse Bei adiabatischen Prozessen ist kein Wärmeaustausch zwischen der Umgebung und dem System zugelassen. In diesem Fall gilt für die innere Energie U du dq d d da dq ist. Da die innere Energie eine Zustandsfunktion ist, gilt für ihr Differential bei konstanter Molzahl n : du U d + U d oder, da U nc ist : du n C d U + d U Für ein ideales Gas ist, da U nicht von der Wechselwirkungsenergie abhängen kann, weil in einem idealen Gas keine Wechselwirkung zwischen den Gasmolekülen er definitionem auftritt. Oder, anders ausgedrückt : Wenn const ist, ist
34 34 auch const, d.h. das System antwortet auf jede an ihm geleistete olumenarbeit mit einer gleich großen, aber entgegengesetzt gerichteten Druckarbeit. Damit gilt jetzt du d n C d Für den Druck wird das Allgemeine Gasgesetz nr eingesetzt : d nr nc d bzw. d C R d Nach dieser Searation der ariablen kann die Gleichung integriert werden : ln C R ln oder C / R bzw. C v / R C / R const Ersetzt man durch das Allgemeine Gasgesetz R, ergibt sich aus C / R const C + R R C / R const Der Faktor C R R / wurde weggelassen, da er mit in die Konstante gezogen werden kann. Außerdem kann aus dem Produkt die C /R-te Wurzel gezogen werden, ohne daß sich die Aussage der Konstanz ändert.
35 35 C + R C const H Aus C ( U + ) ( U + R ) U U folgt C C + R, da für ideale Gase C gilt. (wieder wegen der fehlenden Wechselwirkung zwischen den Gasmolekülen) Für adiabatische Prozesse gilt demnach C / C κ const mit C κ C 3.5 Der Carnot-Prozeß 84 führte Carnot einen Kreisrozeß ein, der auf Isothermen und Adiabaten verläuft. In vier reversiblen Schritten wird ein ideales Gas zu seinem Ausgangszustand zurückgeführt :. isotherme Exansion von A nach B. adiabatische Exansion von B nach C 3. isotherme Komression von C nach D 4. adiabatische Komression von D nach A Im ersten Schritt bei emeratur o leistet das Gas die Arbeit A w d B nr o ln A B Diese Arbeit muß durch Wärmeaufnahme aus der Umgebung ausgeglichen werden : w Q
36 36 Entsrechend wird im Schritt 3 die Wärme Q an ein Wärmereservoir der emeratur u abgegeben : C + w3 nru ln Q 3 D In den beiden adiabatischen Schritten wird keine Wärme aufgenommen oder abgegeben, die entsrechenden olumenarbeiten sind dabei gegeben durch w nc d und w nc ( ) 4 u o nc ( ) o u
37 37 Für die olumenverhältnisse gilt, da B und C sowie A und D jeweils auf Adiabaten liegen. B C u o κ A D oder B A C D Beim Durchlaufen des Carnot-Prozesses gewinnt man also die Arbeit : B nr ln nc ( ) w ges o + u o A C nru ln nc ( u o) B nr ln ( o u) A D Q Q 3 Der Carnot-Prozeß bietet also eine Möglichkeit, bei Entnahme von Wärme aus einem höheren Niveau und Abgabe auf ein niedrigeres Niveau Arbeit zu gewinnen (Wärmekraftmaschine). Umgekehrt läßt sich beim Durchlaufen des Carnot-Prozesses in entgegengesetzter Richtung durch Arbeitseinsatz eine Wärmeume (z.b. für Nutzung der Wärme des oberen Niveaus zu Heizzwecken) oder eine Kältemaschine (zum Abkühlen des Reservoirs des unteren Niveaus) modellhaft konstruieren. Einschub : In einem -Diagramm bedeutet eine Fläche eine Energie oder Arbeit. Wird die Fläche im Uhrzeigersinn durchlaufen, gibt das System Energie ab. Der Carnot- Prozeß, der die Fläche ABCD umschließt, bedeutet also eine Energieabgabe an die Umgebung. Da das System zum Ausgangsunkt A zurückkehrt, also den Ausgangszustand wieder erreicht, muß die Energie, die an die Umgebung abgegeben wird, aus der Umgebung selbst aufgenommen worden sein. Diese Energieaufnahme kann nur auf den Isothermen assieren, da auf Adiabaten der Energieaustausch er definitionem nicht stattfindet. Bei der Exansion AB wird
38 38 Wärme aus der Umgebung aufgenommen, damit die emeratur konstant bleibt. Allerdings wird bei der isothermen Komression CD wieder Wärme an die Umgebung abgegeben. Da aber die obere Isotherme steiler ist als die untere, d.h. der emeraturunterschied zwischen A und B würde größer sein als zwischen C und D, wird durch den Carnot-Prozeß netto Wärme aus der Umgebung aufgenommen, die dann als mechanische Energie wieder abgegeben wird. Diese Umwandlung ist aber, wie die Rechnung zeigt, nicht vollständig.
39 39 4. Der zweite Hautsatz der Wärmelehre 4. Die Entroie Die zentrale Größe der hermodynamik ist die Wärme q. Bei Kenntnis der Wärmekaazität eines Systems ist sie leicht über die emeratur zu messen. Oder aus adiabatischen orgängen von Gasen kann χ C Cv und darüber dann wieder die Wärme bestimmt werden. Aber die Wärme hat den großen Nachteil, daß sie wegabhängig ist, sie ist keine Zustandsgröße. Nun gibt es jedoch ein mathematisches erfahren, das erfahren des integrierenden Nenners, das aus einem nicht totalen Differential ein totales macht, oder in die hermodynamik übersetzt : das aus einer wegabhängigen Größe eine Zustandsfunktion macht. Für die auf reversiblen Wegen ausgetauschte Wärme ist der "integrierende Nenner" die emeratur, so daß sich als Definition der neuen Größe S, die Entroie genannt wird, ergibt : ds dqrev (Es muß hier eine Einschränkung auf reversible Prozesse durchgeführt werden, denn für andere Wege ergeben sich andere integrierende Nenner, da diese vom Weg abhängen.) Durch diese Definition bedingt ergibt sich, daß die Entroie S keine Größe ist, die einen organg oder ein erhalten beschreibt. Die Entroie ist vielmehr ein Maß für die Wärme, aber auch, wie anderswo gezeigt wird, ein Maß für den Ordnungszustand W eines Systems. S k ln W Es hat sich gezeigt, daß das Konzet der Entroie außerordentlich wirkungsvoll ist, es muß jedoch der Nachteil der Unanschaulichkeit in Kauf genommen werden.
40 4 4. Die Richtung sontan ablaufender Prozesse Als Beisiel für die Bedeutung der Größe Entroie soll hier die Richtung sontan ablaufender Prozesse in isolierten Systemen abgeleitet werden : Eine der möglichen Formen des zweiten Hautsatzes lautet : Für Kreisrozesse ist die vom System auf reversiblen Wegen geleistete Arbeit am größten. dw dw al lg emein rev Das Kreisintegral wird jetzt ersetzt durch jeweils ein Integral des Hin- und des Rückweges. Dabei wird der Rückweg jeweils als reversibel vorausgesetzt. ( Dies ist nur scheinbar eine Einschränkung, da das ursrüngliche allgemeine Integral ersetzt werden kann durch zwei Kreisintegrale, für die der Rückweg jeweils reversibel ist. Dann wird die folgende Überlegung für jedes eilintegral searat durchgeführt.) B A dw all + A B dw rev B A dw rev Jetzt wird zur Entroie übergegangen : -dw dq du + A B dw rev B B B B al lg al lg rev A A A A dq du dq du rev Die Integrale über du sind gleich, da U eine Zustandsfunktion und damit unabhängig vom Weg ist. Sie heben sich daher aus der Gleichung heraus. Nach der Division durch die emeratur folgt : B B B dq dq al lg rev ds A A A S
41 4 In einem isolierten System ist aber dq, und damit gilt : B A ds S In einem isolierten System nimmt die Entroie also niemals ab. Es soll hier jedoch nochmals darauf hingewiesen werden, daß die Entroiezunahme nur für isolierte Systeme gilt. Für geschlossene oder offene Systeme, wie z. B. die Erde, gilt dies nicht, da durch Energiezufuhr (Sonnenenergie im Falle der Erde) immer wieder der Entroiezunahme entgegengewirkt wird. 4.3 Der Wirkungsgrad des Carnot-Prozesses Eine Maschine, die auf reversiblen Wegen arbeitet und somit die maximal mögliche Arbeit leistet, ist die Carnot'sche Maschine, die auf Adiabaten und Isothermen arbeitet. Zeichnet man diesen Kreisrozeß in ein Druck-olumen-Diagramm, so ist die vom Kreisrozeß umschlossene Fläche direkt roortional der geleisteten Arbeit. Der Wirkungsgrad η, d.h. die geleistete Arbeit ro zugeführter Wärme, ist dann : η ( w) q nr ( ) o q u ln A B wo o die emeratur des Reservoirs, aus dem Wärme abgeführt wird, und u die niedrigere emeratur des zweiten Reservoirs ist.
42 4 Im Kaitel 3 hatten wir bereits die Wärmen und olumenarbeiten der einzelnen Wege berechnet. Für q galt : q nr ln A o und B q C 3 nru ln D nr u ln A B also η q + q q 3 o u o Da die geleistete Arbeit gleich der Differenz zwischen zugeführter und abgeführter Wärme ist, gilt auch η q ( q ) 3 q und damit q + q q 3 o o u
43 43 oder q q + 3 o u Für einen Kreisrozeß auf reversiblen Wegen ist also die Größe eine Zustandsgröße, nämlich ds, aber das wußten wir ja bereits. dq rev. 4.4 Die Freie Enthalie und die Helmholtz-Energie Wenn der Wirkungsgrad einer Carnot-Maschine kleiner ist als muss im System die Restenergie in einer anderen Form vorliegen. Es liegt nun nahe, diese Energie mit der Entroie zu verknüfen. Diese Restenergie steckt in der nicht in die Rechnung einbezogen Wärmen q und q 4, denn im System selbst kann sie nicht enthalten sein, da die Gesamtenergie (Enthalie) als Zustandsgröße sich durch einen Kreisrozess nicht ändern kann. Die nutzbare Energie einer Wärme-Kraft-Maschine ist die Differenz zwischen der hineingesteckten Wärme dq und der maximal entnehmbaren Energie der Größe dq rev. : E dq - dq rev. dh - ds für isobare orgänge du - ds für isochore orgänge Diese nutzbare Energie ist als Differenz zweier Zustandsgrößen wiederum eine Zustandsgröße und wird als "freie Enthalie" G für isobare orgänge, bzw. als "freie Energie " oder Helmholtz-Energie A für isochore orgänge bezeichnet. Der Zweite Hautsatz der Wärmelehre kann also in derr mathematischen Form der Gibbs- Helmholtz-Gleichungen definiert werden : dg dh ds da du ds
44 Das chemische Potential Da die freie Enthalie G eine zentrale Rolle insbesondere für hysikalische und chemische orgänge (Reaktionen) sielt, hat man der molaren Größe einen besonderen Namen gegeben : das chemische Potential dg d µ n Für Gleichgewichte ist d µ immer Null Da bei sontan ablaufenden Prozessen in isolierten Systemen die Entroie zunimmt, gilt auch dµ dµ im Gleichgewicht für sontane Prozesse in isolierten Systemen Das chemische Potential ist bei reinen Stoffen immer durch dg zu ersetzen. Aber wir werden säter sehen, daß das chemische Potential immer dann seine Berechtigung hat, wenn die freie Enthalie in Stoffgemischen berechnet werden soll.
45 45 5. Mehrkomonenten-Systeme 5. Phasen und Freiheitsgrade Im folgenden sollen Systeme beschrieben werden, in denen es zu hysikalischen Reaktionen (wie Phasenumwandlungen oder Mischungen) kommt, chemische Reaktionen sollen jedoch vorerst ausgeklammert werden. Als Phase bezeichnet man Systembereiche, in denen ein Stoff hysikalisch und chemisch einheitlich existiert. Diese Definition ist jedoch verschwommen, einfacher und klarer ist es, Phasen über die Phasengrenzen zu definieren : Eine Phase ist der Bereich zwischen zwei Phasengrenzen. Und als Phasengrenze ist jede Diskontinuität eines Systems zu verstehen. rägt man eine thermodynamische Größe, z. B. die Enthalie gegen die emeratur auf, so findet man bei Änderung einer Phase, z.b. des Aggregatzustands, Srünge und bezeichnet diese Stellen als Phasengrenzen. Ordnung. ritt der Srung nicht in der Zustandsgröße selbst, sondern in ihrer Ableitung auf (die Zustandsgröße hat dann einen Knickunkt), so sricht man von Phasengrenzen. Ordnung, usw. Aufgrund der Meßunsicherheit ist es jedoch zunehmend schwieriger, Phasengrenzen höherer Ordnung zu erkennen und hier treten dann Interretationsunterschiede auf. Schließt man chemische Reaktionen aus, bei denen sich die Molzahl ändert, so kann jedes System durch drei Zustandsgrößen beschrieben werden. on diesen Zustandsgrößen sind zwei unabhängige ariable, die dritte ist von diesen abhängig, d. h. das System besitzt zwei Freiheitsgrade. Sind die beiden Unabhängigen z.b. der Druck und die emeratur, so kann ein System in einem --Diagramm vollständig beschrieben werden. Die Phasengrenzen sind in einer solchen Darstellung Kurven, d. h. eindimensionale Gebilde, auf denen das System den Freiheitsgrad besitzt. Absolut fest liegen die rielunkte (der Freiheitsgrad des Systems ist also ) als Schnitte zweier Phasengrenzen. In Abbildung 5 sind die Druck-emeraturdiagramme von Wasser, Kohlenstoff und CO dargestellt. ersuchen wir jetzt, ein solches --Diagramm zu interretieren : Bei bar ist z.b. das H O bis 73,5 K fest, dann tritt ein Phasensrung auf, H O wird flüssig. Einen weiteren Phasensrung hat das H O bei 373 K, hier geht es über in die Gashase. Der rielunkt des Wassers liegt bei 73,6 K und,67 bar. Hier sind alle drei Phasen
46 46 nebeneinander existent. Aus dem Diagramm ist auch zu erkennen, daß es einen Weg gibt, bei dem man ohne Phasensrung von flüssigen zum gasförmigen Zustand übergehen kann. Bei hohen Drücken und hohen emeraturen bilden Flüssigkeiten und Gase nur eine Phase, das Fluidum.
47 47 Erhöht man den Druck von CO bei Raumtemeratur, so wird das Gas bei 67 bar flüssig und bei über 3 bar fest. Bei emeraturerniedrigung bei bar verfestigt sich das CO bei etwa K. Bisher haben wir als Phasen nur die Aggregat-Zustände gasförmig, flüssig und fest betrachtet. Außer im Gaszustand können aber in den beiden anderen Aggregat- Zuständen mehrere Phasen auftreten, wie z.b. aus den Schwefel-Modifikationen bekannt ist. Als ein Beisiel für einen Stoff mit mehreren Phasen im festen Zustand ist hier das Phasendiagramm von Kohlenstoff aufgezeichnet. Kohlenstoff liegt als Festkörer in den Phasen Grahit oder Diamant vor, wobei sich Grahit, das bei Zimmertemeratur beständig ist, durch Druckerhöhung in Diamant umwandeln läßt. (Der organg ist jedoch technisch so aufwendig, daß die künstlichen Diamanten teurer sind als die in der Erdgeschichte entstandenen). Es soll hier angemerkt werden, daß es nicht nur mehr als drei Phasen gibt, auch Aggregat-Zustände gibt es mehr als drei. Als Beisiel seien hier genannt : suerfluide Media, Plasmen, Suraleiter etc. 5. Die Clausius-Claeyron- Gleichung Zur Ableitung der Gleichung für Phasenumwandlungen wird auf das chemische Potential µ zurückgegriffen. Im Gleichgewicht zwischen zwei Phasen α und β ist das chemische Potential konstant, d.h. die Änderungen von µ sind in beiden Phasen gleich. α β µ dµ d Nach den Regeln für ein totales Differential kann dµ ersetzt werden : dµ µ d µ + d Im Kaitel über die Entroie hatten wir bereits die Beziehung µ S
48 48 kennen gelernt. Für den zweiten erm gilt µ Damit wird aus der Gleichgewichtsbedingung S α d + α d S β d + β d oder S d d Da in der Beziehung für die Entroie der Druck konstant sein soll, kann folgende Ersetzung durchgeführt werden, S q rev H wobei H die Prozessenthalie des Phasenübergangs ist. Damit haben wir aber auch bereits die differentielle Form der Clausius-Claeyron-Gleichung gefunden. H d d Diese differentielle Form gilt exakt. Für den tatsächlichen Gebrauch wird aber die integrale Form der Clausius-Claeyron-Gleichung benötigt. Zu ihrer Ableitung sind jedoch mehrere Annahmen notwendig. Setzt man (Gas) und nimmt ideales erhalten an, so ergibt sich die (integrale) Gleichung H ln + Const. R
49 Mehrkomonentensysteme und Mischungen Bisher wurde die Molzahl als eine Konstante angesehen und es wurden nur Ein-Stoff- Systeme betrachtet. Hat man es jedoch mit Mehr-Stoff-Systemen zu tun, so tragen die einzelnen Komonenten im erhältnis ihrer Molzahlen zu den einzelnen Zustandsfunktionen bei, also z. B. zur Freien Enthalie : Im Gleichgewicht ist d G n µ + n µ +... µ G oder nach Gibbs-Duhem : n idµ i n i i ernachlässigt man die Wechselwirkungen zwischen den Molekülen verschiedener Substanzen, was z. B. für Gase meist zulässig ist, so erhält man als Gesamtdruck eines Systems nach Dalton das Partialdruckgesetz aus i ges. R R i ni n ges. Zur Ableitung von Mischungsenthalie und Mischungsentroie gehen wir vom totalen Differential der Freien Enthalie eines Stoffes aus : dg d ( H S ) dq+ d ds Sd dsd Bei konstantem Druck gilt also S dg d,was bereits bekannt ist. Für konstante emeratur (d) und ideales erhalten nr folgt aus dg nr dg G d d nr ln
50 5 Da man sich meist auf Normalbedingungen ( 98 K, bar) bezieht, wird häufig geschrieben : G( ) G + nr ln Wir wollen jetzt die irreversible Mischung zweier Gase betrachten, die vor der Mischung durch eine Wand getrennt sind. Der Druck in beiden Kammern sei gleich. or der Mischung ist die Gesamtenthalie G + n A µ A + na R ln nb µ B + n B R ln Der Druck ändert sich nach dem Entfernen der Wand nicht, da ( ) + n R A B A A A gilt und entsrechend für B. Also damit auch ( + ) ( + ) ( + ) A B A B A B oder ges Nach der Mischung gilt das Dalton'sche Partialdruckgesetz + A B
51 5 und damit A Gn na A + R nb B R + µ ln µ + ln B Die Mischungsenthalie ist also : G G Gv nr x ln x mix n i i wobei die Molzahlen durch den Molenbruch x ersetzt wurden : x ni n i i i Wegen S G für die Mischungsentroie gilt S nr ( x ln x ) mix i i Da die Molenbrüche immer kleiner als sind, folgt S mix > d. h. der Mischungsvorgang ist irreversibel. 5.4 Oberflächen. Die Oberflächensannung Zwei Komonenten bzw. Phasen sind jeweils durch eine Grenzfläche getrennt. Während innerhalb der Komonenten normalerweise isotroe erhältnisse herrschen, d.h. auf einen Punkt wirken von allen Seiten die gleichen Kräfte, ist eine Oberfläche stark anisotro. Dies drückt sich durch die Oberflächensannung γ aus. Wird eine Oberfläche σ um dσ geändert, wird dazu eine Arbeit benötigt : dw γ dσ
52 5 Damit ändert sich z.b. die Innere Energie : du dq + dw dq + γ dσ Gasgefüllte Hohlräume in einer Flüssigkeit haben aufgrund der Oberflächensannung die endenz die Oberfläche zu verringern. Im Gleichgewicht wird diese endenz durch einen Überdruck im Inneren des Hohlraums komensiert : Kraft nach außen Kraft nach innen da Arbeit Kraft x Weg und Druck Kraft / Fläche gilt : i d a d + dw Mit σ 8π σ 4πr, d r dr und 4 3 π r, d 4π r dr σ dr 3 folgt nach dem Einsetzen i a 8πγr γ 4πr r Für ein kugelförmiges Gebilde ist dies die Lalace-Gleichung i a + γ r d.h. der Druck auf der Innenseite einer gekrümmten Oberfläche ist immer größer als der Druck auf der Außenseite. Dies gilt auch für rofen, deren Binnendruck in Abhängigkeit vom Druck über einer ebenen Fläche durch die Kelvin'sche Gleichung beschrieben wird : rofen) γ γ γ ex + + rr rr r ( Die Lalace-Gleichung ist also ein Sezialfall der allgemeineren Kelvin-Gleichung.
Einführung in die Physikalische Chemie für das Lehramt
 Einführung in die Physikalische Chemie für das Lehramt orlesungsscrit Ernst-Peter Röth Sommersemester Inhaltsverzeichnis orbesrechung. Gase und Elektrolyte. Definitionen. Gasgesetze.3 Elektrolyte.4 Das
Einführung in die Physikalische Chemie für das Lehramt orlesungsscrit Ernst-Peter Röth Sommersemester Inhaltsverzeichnis orbesrechung. Gase und Elektrolyte. Definitionen. Gasgesetze.3 Elektrolyte.4 Das
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1. Thermodynamische Potentiale, Maxwellgleichungen
 69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der erste Hauptsatz der TD- Lernziele
 Der erste Hautsatz der D- Lernziele o Einleitung o Zustandgrössen und funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hautsatz der hermodynamik o olumenarbeit o Wärmeübergänge o Die
Der erste Hautsatz der D- Lernziele o Einleitung o Zustandgrössen und funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hautsatz der hermodynamik o olumenarbeit o Wärmeübergänge o Die
4.6 Hauptsätze der Thermodynamik
 Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Thermodynamik.6 Hautsätze der Thermodynamik.6. Erster Hautsatz: Energieerhaltungssatz In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Musterlösung Übung 3
 Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
Zur Thermodynamik des idealen Gases (GK Physik 1)
 Zur hermodynamik des idealen Gases (GK Physik 1 Zusammenfassung im Hinblick auf Prozesse. Reinhard Honegger, im Januar 2012. 1 Grundbegriffe 1.1 Zustandsgleichung = Ideale Gasgleichung Druck, olumen, emeratur
Zur hermodynamik des idealen Gases (GK Physik 1 Zusammenfassung im Hinblick auf Prozesse. Reinhard Honegger, im Januar 2012. 1 Grundbegriffe 1.1 Zustandsgleichung = Ideale Gasgleichung Druck, olumen, emeratur
2. Hauptsätze der Thermodynamik
 . Hautsätze der hermodynamik ekannt sind vor allem der I. und II. Hautsatz der hermodynamik. Man sricht auch vom 0. Hautsatz und es gibt zusätzlich den III. Hautsatz. 0. HS: Einführung der emeratur als
. Hautsätze der hermodynamik ekannt sind vor allem der I. und II. Hautsatz der hermodynamik. Man sricht auch vom 0. Hautsatz und es gibt zusätzlich den III. Hautsatz. 0. HS: Einführung der emeratur als
T 1 T T Zustandsverhalten einfacher Systeme (Starthilfe S ) - Prozess und Zustandsänderung. Prozess (Q 12
 . Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
. Zustandserhalten einfacher Systeme (Starthilfe S. 9-38) - Prozess und Zustandsänderung Zustandsänderung δq Prozess (Q ) - thermodynamisch einfache Systeme reiner Stoff feste flüssige damfförmige Phase
Zur Erinnerung. Wärmetransport durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung. Planck sches Strahlungsgesetz. Stefan-Boltzman-Gesetz
 Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Zur Erinnerung Stichworte aus der 9. orlesung: Wärmetransort durch: -Wärmekonvektion -Wärmestrahlung -Wärmeleitung Planck sches Strahlungsgesetz Stefan-Boltzman-Gesetz Wiensches erschiebungsgesetz Hautsätze
Der Erste Hauptsatz der TD- Lernziele
 hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
Thermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden.
 Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
Wärmemenge: hermische Energie kann nicht mehr beliebig in andere Energieformen umgewandelt werden. Sie kann aber unter gewissen oraussetzungen von einem Körer auf einen nderen übertragen werden. Dabei
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
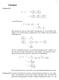 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS07/8 Gudrun Hiller Shaukat Khan Kaitel 6 Seziische Wärme von Gasen Bei einatomigen Gasen (z.b. He): Bei zweiatomigen Gasen (z.b. N, O ): N k A Freiheitsgrade ür die kinetische Energie
Physik I U Dortmund WS07/8 Gudrun Hiller Shaukat Khan Kaitel 6 Seziische Wärme von Gasen Bei einatomigen Gasen (z.b. He): Bei zweiatomigen Gasen (z.b. N, O ): N k A Freiheitsgrade ür die kinetische Energie
5. Die Thermodynamischen Potentiale
 5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
5. Die hermodynamischen Potentiale 5.1. Einführung der Potentiale Gibbs'sche Fundamentalgleichung. d = du + d, du + d δ Q d = = Ist die Entroie als Funktion von U und bekannt, = ( U, ) dann lassen sich
Statistische Physik - Theorie der Wärme (PD Dr. M. Falcke)
 Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
Freie Universität Berlin W 006/007 Fachbereich Physik 8..006 tatistische Physik - heorie der Wärme (PD Dr. M. Falcke) Übungsblatt 9: hermodynamische Identitäten, hermische/kalorische Zustandsgleichung,
Mitschrift Thermodynamik
 Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Mitschrift hermodynamik Herleitung für den Gasdruck Berechnung des oberen Kreisradius d cosϕ dϕ dψ d N eilchen im Gesamtvolumen dn d N Aufschlagswahrscheinlichkeit eines eilchens Fläche df df sinϕ Gesamte
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
4 Hauptsätze der Thermodynamik
 I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
Lösungen zur Übungsklausur Thermodynamik WS 2003/04
 Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Aufgaben Kreisprozesse. 1. Ein ideales Gas durchläuft den im V(T)- Diagramm dargestellten Kreisprozess. Es ist bekannt:
 Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
14 Massenwirkungsgesetz
 14 Massenwirkungsgesetz Im vorherigen Abschnitt haben wir uns mit der Mischungsentroie beschäftigt, die aber nur einen Asekt der Mischung von idealen Gasen berücksichtigt, nämlich des Mischens und rennens
14 Massenwirkungsgesetz Im vorherigen Abschnitt haben wir uns mit der Mischungsentroie beschäftigt, die aber nur einen Asekt der Mischung von idealen Gasen berücksichtigt, nämlich des Mischens und rennens
3 Diskussion und Beispiele
 Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
Woche 2 3 Diskussion und Beispiele 31 Abhängigkeit zwischen kalorischer und thermischer Zustandsgleichung Die kalorische und die thermische Zustandsgleichungen sind nicht unabhängig Aus den Integrabilitätsbedingungen
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
GPH2 Thermodynamik. 27. September Dieser Entwurf ist weder vollständig oder fehlerfrei noch ein offizielles Script zur Vorlesung.
 GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
GPH2 Thermodynamik Dieser Entwurf ist weder ollständig oder fehlerfrei noch ein offizielles Scrit zur Vorlesung. Für Anregungen und Kritik: mail@sibbar.de 27. Setember 2004 GPH2 Thermodynamik Seite 2 on
Allgemeines Gasgesetz. PV = K o T
 Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Physikalische Chemie Physikalsiche Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/10 5. Zustandsfunktionen Idealer und Realer Gase. ZustandsÄnderungen
 Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
Prof. Dr. Norbert Ham 1/10 5. Zustandsfunktionen Idealer und Realer Gase ZustandsÄnderungen Die rennung zwischen unserem System und der ÅUmweltÇ wird durch eine Wand realisiert. WÄnde kånnen unterschiedliche
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
Einführung in die Physik I Wärmelehre/hermodynamik Wintersemester 7 ladimir Dyakonov #3 am..7 Folien unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html.3 Ideales Gas Exerimentelle Bestimmung der
(b) Schritt I: freie adiabatische Expansion, also ist δw = 0, δq = 0 und damit T 2 = T 1. Folglich ist nach 1. Hauptsatz auch U = 0.
 3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
Der Erste Hauptsatz der TD- Lernziele
 hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
hermodynamik (D) Fundamentale heorie der makroskoischen Eigenschaften der Materie: - Sontane Prozesse - Konzet der emeratur - Phasenübergänge - Energetik makroskoischer Phasen und chemischer Reaktionen
I el U el. P el W V 23+W F23. Musterlösung SS Aufgabe (34 Punkte) a) Energiebilanz für die Kammer A im Zeitintervall t 12 :
 Musterlösung SS. Aufgabe Punkte a Energiebilanz für die Kammer A im Zeitintervall t : W A, + W V A U A U A W A, P el t U el I el t W V A 0 U A U A m A c v A A 5 m A A V A R A 6 c v κ R 7 A A A A 8 A B
Musterlösung SS. Aufgabe Punkte a Energiebilanz für die Kammer A im Zeitintervall t : W A, + W V A U A U A W A, P el t U el I el t W V A 0 U A U A m A c v A A 5 m A A V A R A 6 c v κ R 7 A A A A 8 A B
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
1 Thermodynamik allgemein
 Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
m T 1 0.5kg 8.6K = 7535 m T 2 0.5kg 10.4K = 6923 J
 3 Lösungen Lösung zu 39. Zugeführte Energie ro Schritt E W h 36kJ..5l Wasser nähern wir mit der Masse.5kg an. mol Wasser hat eine Masse von 8g. Also sind in dem Behälter 28.78mol Wasser. Aus den beiden
3 Lösungen Lösung zu 39. Zugeführte Energie ro Schritt E W h 36kJ..5l Wasser nähern wir mit der Masse.5kg an. mol Wasser hat eine Masse von 8g. Also sind in dem Behälter 28.78mol Wasser. Aus den beiden
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
Der Zweite Hauptsatz der D- Lernziele o Einleitung o Entropie (Definition, Entropie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hauptzatz der D o Die Entropieänderungen bei speziellen
Elektrizität. = C J m. Das Coulomb Potential φ ist dabei:
 Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
FAQ Entropie. S = k B ln W. 1.) Ist die Entropie für einen Zustand eindeutig definiert?
 FAQ Entroie S = k B ln W 1.) Ist die Entroie für einen Zustand eindeutig definiert? Antwort: Nein, zumindest nicht in der klassischen Physik. Es sei an die Betrachtung der Ortsraum-Entroie des idealen
FAQ Entroie S = k B ln W 1.) Ist die Entroie für einen Zustand eindeutig definiert? Antwort: Nein, zumindest nicht in der klassischen Physik. Es sei an die Betrachtung der Ortsraum-Entroie des idealen
Kurze Einführung in die Thermodynamik mit Begriffsklärungen
 Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Die Innere Energie U
 Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Lösungsvorschlag Übung 2
 Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalie & Gibbs Gleichungen 4.3. Gibbs sche Gleichungen Fundamentalgleichungen der D weitere Fundamentalgleichungen basierend auf: einsetzen von (): d d d Ausdifferenzierung der Definition
4. Freie Energie/Enthalie & Gibbs Gleichungen 4.3. Gibbs sche Gleichungen Fundamentalgleichungen der D weitere Fundamentalgleichungen basierend auf: einsetzen von (): d d d Ausdifferenzierung der Definition
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aufgaben zum Stirlingschen Kreisprozess Ein Stirling-Motor arbeite mit 50 g Luft ( M= 30g mol 1 )zwischen den Temperaturen = 350 C und T3
 Aufgaben zum Stirlingschen Kreisrozess. Ein Stirling-Motor arbeite mit 50 g Luft ( M 0g mol )zwischen den emeraturen 50 C und 50 C sowie den olumina 000cm und 5000 cm. a) Skizzieren Sie das --Diagramm
Aufgaben zum Stirlingschen Kreisrozess. Ein Stirling-Motor arbeite mit 50 g Luft ( M 0g mol )zwischen den emeraturen 50 C und 50 C sowie den olumina 000cm und 5000 cm. a) Skizzieren Sie das --Diagramm
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
10. Thermodynamik Der erste Hauptsatz Der zweite Hauptsatz Thermodynamischer Wirkungsgrad Der Carnotsche Kreisprozess
 Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
Inhalt 10.10 Der zweite Hauptsatz 10.10.1 Thermodynamischer Wirkungsgrad 10.10.2 Der Carnotsche Kreisprozess Für kinetische Energie der ungeordneten Bewegung gilt: Frage: Frage: Wie kann man mit U Arbeit
3 Der 1. Hauptsatz der Thermodynamik
 3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test
 PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag
 4: hermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag 1. Joule-homson-Effekt Ein Gasstrom wird von Bereich 1 (siehe Abbildung) mit einem Kolben durch eine oröse Wand
4: hermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 10 Lösungsvorschlag 1. Joule-homson-Effekt Ein Gasstrom wird von Bereich 1 (siehe Abbildung) mit einem Kolben durch eine oröse Wand
22. Entropie; Zweiter Hauptsatz der Wärmelehre
 22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
22. Entropie; Zweiter Hauptsatz der Wärmelehre Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt Beispiel: Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/8 15. Chemische Thermodynamik. ZustandsÄnderungen
 Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
Physikalische Chemie Physikalische Chemie I oe 2009 Prof. Dr. Norbert Ham 1/8 15. Chemische hermodynamik Zustandsnderungen Mit Hilfe des chemischen Potentials, knnen wir offene und kommunizierende ysteme
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus.
 1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
Elektrolytische Leitfähigkeit
 Elektrolytische Leitfähigkeit 1 Elektrolytische Leitfähigkeit Gegenstand dieses Versuches ist der Zusammenhang der elektrolytischen Leitfähigkeit starker und schwacher Elektrolyten mit deren Konzentration.
Elektrolytische Leitfähigkeit 1 Elektrolytische Leitfähigkeit Gegenstand dieses Versuches ist der Zusammenhang der elektrolytischen Leitfähigkeit starker und schwacher Elektrolyten mit deren Konzentration.
PC-Übung Nr.3 vom
 PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
Die innere Energie and die Entropie
 Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
5 Thermodynamische Potentiale
 3 Woche 5 hermodynamische Potentiale 51 Formale Einführung der Potentiale Es ist möglich, die extensiven Zustandsfunktionen (mit der Dimension der Energie) zu bilden, die die anderen ariablen als S,, N
3 Woche 5 hermodynamische Potentiale 51 Formale Einführung der Potentiale Es ist möglich, die extensiven Zustandsfunktionen (mit der Dimension der Energie) zu bilden, die die anderen ariablen als S,, N
Theoretische Physik 4 Thermodynamik und Statistische Physik
 Theoretische Phsik 4 Thermodnamik und Statistische Phsik Prof. Dr. Eric Lutz Universität Erlangen-Nürnberg Inhaltsverzeichnis 1 Thermodnamische Konzete 3 1.1 Was ist Thermodnamik?...........................
Theoretische Phsik 4 Thermodnamik und Statistische Phsik Prof. Dr. Eric Lutz Universität Erlangen-Nürnberg Inhaltsverzeichnis 1 Thermodnamische Konzete 3 1.1 Was ist Thermodnamik?...........................
Thermodynamik ist eine Theorie, in der, wie der Name sagt, die Begriffe Temperatur und. Länge, Zeit, Masse
 Biologische Thermodynamik (I) Wintersemester 007/08 orlesungen: Wolfram Liebermeister Literatur: G. Kluge & Neugebauer: Grundlagen der Thermodynamik, Sektrum Akadem. erlag, 994 R. Heinrich & S. Schuster,
Biologische Thermodynamik (I) Wintersemester 007/08 orlesungen: Wolfram Liebermeister Literatur: G. Kluge & Neugebauer: Grundlagen der Thermodynamik, Sektrum Akadem. erlag, 994 R. Heinrich & S. Schuster,
Der 1. Hauptsatz. Energieerhaltung:
 Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
Der 1. Hauptsatz Energieerhaltung: Bei einer Zustandsänderung tauscht das betrachtete System Energie ( W, Q mit seiner Umgebung aus (oft ein Wärmereservoir bei konstantem. Für die Energiebilanz gilt: U
2. Thermodynamik Grundbegriffe Hauptsätze Thermodynamische Potentiale response -Funktionen
 2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
2. Thermodynamik 1 2.1 Grundbegriffe 2 2.2 Hauptsätze 3 2.3 Thermodynamische Potentiale 4 2.4 response -Funktionen G. Kahl & F. Libisch (E136) Statistische Physik I Kapitel 2 5. April 2016 1 / 25 2.1 Grundbegriffe
= n + + Thermodynamik von Elektrolytlösungen. Wdhlg: Chemisches Potential einer Teilchenart: Für Elektrolytlösungen gilt: wobei : und
 Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 8 (Abgabe Di 3. Juli 2012)
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
Theorie der Wa rme Musterlo sung 3.
 heorie der Wa rme Musterlo sung 3 U bung 1 FS 2014 Prof Renner Ideales Gas (i) Zeige, dass fu r ein ideales Gas in einem adiabatischen Prozess die Gleichung /C /C = 0 0, gilt, wobei n die Stoffmenge, R
heorie der Wa rme Musterlo sung 3 U bung 1 FS 2014 Prof Renner Ideales Gas (i) Zeige, dass fu r ein ideales Gas in einem adiabatischen Prozess die Gleichung /C /C = 0 0, gilt, wobei n die Stoffmenge, R
Experimentalphysik II: Thermodynamik
 Exerimentalhysik II: Thermodynamik Zweitversuch-Ferienkurs Sommersemester 09 William Hefter 11/09/2009 Inhaltsverzeichnis 1 Temeratur, Wärme und Arbeit 2 1.1 Einschub zur mathematischen Schreibweise.........................
Exerimentalhysik II: Thermodynamik Zweitversuch-Ferienkurs Sommersemester 09 William Hefter 11/09/2009 Inhaltsverzeichnis 1 Temeratur, Wärme und Arbeit 2 1.1 Einschub zur mathematischen Schreibweise.........................
Thermodynamik. Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen.
 Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Thermodynamik Hauptsatz
 Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
Thermodynamik. Hauptsatz Inhalt Wärmekraftmaschinen / Kälteprozesse. Hauptsatz der Thermodynamik Reversibilität Carnot Prozess Thermodynamische Temperatur Entropie Entropiebilanzen Anergie und Exergie
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
7 Thermodynamik. 7.1 Kinetische Energie des idealen Gases
 7 hermodynamik Wärme: ungeordnete Molekülbewegung Wärmeenergie: kinetische Energie dieser Bewegung emeratur: lineares Maß für den Mittelwert der Energie 7. Kinetische Energie des idealen Gases ρgas ρ Festk.
7 hermodynamik Wärme: ungeordnete Molekülbewegung Wärmeenergie: kinetische Energie dieser Bewegung emeratur: lineares Maß für den Mittelwert der Energie 7. Kinetische Energie des idealen Gases ρgas ρ Festk.
Amphiphile Moleküle vereinen zwei inkompatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrophil + hydrophob)
 3. Amhihile 3.1. Allgemeines Amhihile Moleküle vereinen zwei inkomatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrohil + hydrohob) Tenside, Detergentien, surfactant, Liide, Blockcoolymere,...
3. Amhihile 3.1. Allgemeines Amhihile Moleküle vereinen zwei inkomatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrohil + hydrohob) Tenside, Detergentien, surfactant, Liide, Blockcoolymere,...
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 02. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 02. 07. 2007 Inhaltsverzeichnis
Grundlagen der Physik II Othmar Marti 02. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 02. 07. 2007 Inhaltsverzeichnis
Thermodynamik. Kapitel 4. Nicolas Thomas
 Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Formelsammlung. Experimentalphysik II. Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester Pascal Del Haye 27.
 Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Physik III im Studiengang Elektrotechnik
 Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Physik III im Studiengang Elektrotechnik -. Hauptsatz der Thermodynamik - Prof. Dr. Ulrich Hahn WS 2008/09 Energieerhaltung Erweiterung des Energieerhaltungssatzes der Mechanik Erfahrung: verschiedene
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Physikalische Chemie I
 M.Bredol / M hysikalische Chemie I / 6.7.2017 1 hysikalische Chemie I Nachname orname Matrikel Aufgabe unkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Wasser besitzt die folgenden charakteristischen
M.Bredol / M hysikalische Chemie I / 6.7.2017 1 hysikalische Chemie I Nachname orname Matrikel Aufgabe unkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Wasser besitzt die folgenden charakteristischen
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Physikalische Chemie Praktikum. Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln
 Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Zur Erinnerung. p isotherm. Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: Kreisprozesse:
 Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
Zur Erinnerung Stichworte aus der 20. Vorlesung: Poisson sche leichungen/adiabaten- Gleichungen: T V V 1 const. const. adiabatisch ( V ) 0 V V 0 R T0 isotherm ( V ) V Kreisrozesse: Ein thermodynamisches
II. Wärmelehre. II.2. Die Hauptsätze der Wärmelehre. Physik für Mediziner 1
 II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
II. Wärmelehre II.2. Die auptsätze der Wärmelehre Physik für Mediziner 1 1. auptsatz der Wärmelehre Formulierung des Energieerhaltungssatzes unter Einschluss der Wärmenergie: die Zunahme der Inneren Energie
Hauptsatz der Thermodynamik
 0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
Adsorption an Festkörpern
 Adsortion an Festkörern Anreicherung eines Stoffes findet im wesentlichen nur an der Festköreroberfläche statt. Die Lage der Grenzfläche ist damit sehr genau bestimmt. Nicht nur die Größe der für die Adsortion
Adsortion an Festkörern Anreicherung eines Stoffes findet im wesentlichen nur an der Festköreroberfläche statt. Die Lage der Grenzfläche ist damit sehr genau bestimmt. Nicht nur die Größe der für die Adsortion
